
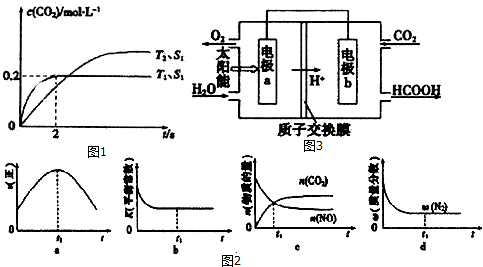
分析 1、v=$\frac{△c}{△t}$,对于一个反应而言,用不同的物质表示的反应速率不同,反应速率之比等于系数之比.
2、催化剂可以提高反应速率,对转化率没有影响.
3、可逆反应达到平衡状态的判定,对于有体积变化的气体系统,压强不变、密度不变、反应速率不变是常用的依据;平衡的移动,遵循勒夏特列原理,平衡向减弱因素的方向移动.
4、盖斯定律,可以通过多个反应的加和,求得总反应的反应热.
5、在电解池中,失电子的是负极,得电子的是正极.
解答 (1)①在T1温度下,0-2s内的平均反应速率v(N2)=$\frac{1}{2}$$\frac{△c(CO2)}{△t}$=$\frac{1}{2}$×$\frac{0.2mol•L-1}{2s}$=0.05mol/(L•s)
故答案为:0.05;
②催化剂可以提高反应速率,对转化率没有影响.
故答案为:不变;
③a.反应达到平衡状态时,各物质的反应速率不再变化,故错误.b.由图1分析可知,反应是放热反应,该反应在绝热、恒容的密闭体系中进行,相当于升高温度,平衡向左移动,平衡常数减小,当温度不变时,化学平衡常数不变,故正确.c.二氧化碳和一氧化氮的物质的量相等时,该反应不一定达到平衡状态,故错误.d.反应达到平衡状态时,各物质的质量分数不再发生变化,故正确.
故答案为:b、d;
(2)①已知:Ⅰ、CH4(g)+2NO2(g)═N2(g)+CO2(g)+2H2O(g)△H1=-867.0kJ/mol
Ⅱ、2NO2(g)?N2O4(g)△H2=-56.9kJ/mol
根据盖斯定律,Ⅰ-Ⅱ得CH4(g)+N2O4(g)=N2(g)+CO2(g)+2H2O(g),故△H=-867kJ/mol-(-56.9kJ/mol)=-810.1kJ/mol,
故答案为:CH4(g)+N2O4(g)=N2(g)+CO2(g)+2H2O(g)△H=-810.1kJ/mol;
②由图可知左室投入水,生成氧气与氢离子,催化剂a表面发生氧化反应,为负极,右室通入二氧化碳,酸性条件下生成HCOOH,
电极反应式为:CO2+2H++2e-=HCOOH,
故答案为:CO2+2H++2e-=HCOOH.
点评 本题综合了反应速率、化学平衡、盖斯定律、电解池等相关知识,综合性非常的强,而且还考察了学生们的读图能力,难度较大.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:选择题
| A. | 含NaOH 0.2mol | B. | 浓度2mol/L | ||
| C. | 含NaOH 4g | D. | 溶质的质量分数与原溶液相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 过滤 | B. | 两种固体混合 | ||
| C. | 硫酸与氢氧化钠溶液的中和反应 | D. | 蒸发 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②④⑤ | B. | ② | C. | ①③④⑤ | D. | ①②⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 温度 | 平衡时NH3的 物质的量mol |
| T1 | 1.2 |
| T2 | 1.0 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
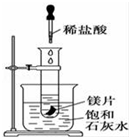 如图所示,把试管放入盛有25℃饱和澄清石灰水的烧杯中,试管中开始放入几小块镁片,再用滴管滴入10mL盐酸于试管中,试回答下列问题:
如图所示,把试管放入盛有25℃饱和澄清石灰水的烧杯中,试管中开始放入几小块镁片,再用滴管滴入10mL盐酸于试管中,试回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | SO2、H2S | B. | NH3、CO2 | C. | Cl2、CO2 | D. | SO2、Cl2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com