
”¾ĢāÄæ”æ¢ń£®¹żĮæĢśĘ¬Óė100mL 0.01mol/LµÄĻ”ŃĪĖį·“Ó¦£¬ÄÜĮæ±ä»ÆĒ÷ŹĘ£¬ČēĶ¼ĖłŹ¾£ŗ

£Ø1£©øĆ·“Ó¦ĪŖ__________·“Ó¦(Ģī”°ĪüČČ”±»ņ”°·ÅČČ”±)”£
£Ø2£©ĪŖĮĖ¼Óæģ²śÉśH2µÄĖŁĀŹ¶ų²»øıäH2µÄ²śĮ棬æÉŅŌŹ¹ÓĆČēĻĀ·½·ØÖŠµÄ______
¢Ł¼ÓH2O ¢Ś¼ÓČė¼øµĪ1mol/LHNO3ČÜŅŗ ¢ŪµĪČė¼øµĪÅØŃĪĖį
¢Ü¼ÓČėŅ»¶ØĮæĢś·Ū ¢Ż¼ÓNaClČÜŅŗ ¢ŽµĪČė¼øµĪĮņĖįĶČÜŅŗ
¢ßŹŹµ±ÉżøßĪĀ¶Č£Ø²»æ¼ĀĒŃĪĖį»Ó·¢£© ¢ąøÄÓĆ10mL0.1mol/LŃĪĖį
A. ¢Ś¢Ū¢Ž¢ß¢ą B. ¢Ū¢Ü7¢ą C. ¢Ū¢Ž¢ß¢ą D. ¢Ū¢Ž¢ß
£Ø3£©Čō½«ÉĻŹö·“Ó¦Éč¼Ę³ÉŌµē³Ų£¬ĶĪŖŌµē³ŲijŅ»¼«²ÄĮĻ£¬ŌņĶµē¼«ÉĻ·¢ÉśµÄµē¼«·“Ó¦ĪŖ________”£
¢ņ£®Ä³ĪĀ¶ČŹ±£¬ŌŚ5 LµÄČŻĘ÷ÖŠ£¬X”¢Y”¢ZČżÖÖĘųĢåµÄĪļÖŹµÄĮæĖꏱ¼äµÄ±ä»ÆĒśĻßČēĶ¼ĖłŹ¾”£ĒėĶعż¼ĘĖć»Ų“šĻĀĮŠĪŹĢā£ŗ

£Ø1£©·ÖĪöÓŠ¹ŲŹż¾Ż£¬Š“³öX”¢Y”¢ZµÄ·“Ó¦·½³ĢŹ½__________”£
£Ø2£©øĆ·“Ó¦ŌŚ3ÖÖ²»Ķ¬Ģõ¼žĻĀ½ųŠŠ£¬ĘäÖŠYĘšŹ¼ÅضČĻąĶ¬£¬ZĘšŹ¼ÅضČĪŖ0£¬·“Ó¦ĪļXµÄÅضČĖę·“Ó¦Ź±¼äµÄ±ä»ÆĒéæöČēĻĀ±ķ:

¢ŁŹµŃé1ÖŠ£¬ŌŚ10~20minÄŚ£¬ŅŌĪļÖŹY±ķŹ¾µÄĘ½¾ł·“Ó¦ĖŁĀŹĪŖ________mol/(L”¤min) £¬50minŹ±£¬ŹµŃé3ÖŠZµÄÅضČ________”£
¢Ś0~20minÄŚ£¬ĘäĖüĢõ¼žŅ»ŃłŹµŃé2ŗĶŹµŃé1µÄ·“Ó¦ĖŁĀŹ²»Ķ¬£¬ĘäŌŅņæÉÄÜŹĒ__________£»ŹµŃé3ŗĶŹµŃé1µÄ·“Ó¦ĖŁĀŹ²»Ķ¬£¬ĘäŌŅņŹĒ________”£
”¾“š°ø”æ ·ÅČČ C 2H++2e-=H2”ü X+3Y![]() 2Z 0.039 1.2 mol/L ŹµŃé2±Č1ĪĀ¶Čøß ŹµŃé3¼ÓČėĮĖ“߻ƼĮ
2Z 0.039 1.2 mol/L ŹµŃé2±Č1ĪĀ¶Čøß ŹµŃé3¼ÓČėĮĖ“߻ƼĮ
”¾½āĪö”æ²śÉśĒāĘųµÄĮæ²»±ä,Ōņ±£Ö¤ĢśĶźČ«ÓėŃĪĖį·“Ó¦;¼Óæģ·“Ó¦ĖŁĀŹ,Ó¦Ōö“óŃĪĖįµÄÅØ¶Č»ņÉżøßĪĀ¶Č,¾Ż“Ė·ÖĪö½ā“š”££Ø1£©øł¾ŻĘ½¾ł»Æѧ·“Ó¦ĖŁĀŹ¹«Ź½¼ĘĖć;(2)ŹµŃé1”¢2ĘšŹ¼ĮæĻąĶ¬,Ę½ŗāÅضČĻąĶ¬,µ«ŹµŃé2“ļµ½Ę½ŗāĖłŠčŅŖµÄŹ±¼ä¶Ģ,·“Ó¦ĖŁĀŹæģ;(3)øł¾ŻŹµŃé1”¢3±Č½ĻŹµŃ鏿¾ŻæÉŅŌÖŖµĄ,ŹµŃé3ĪĀ¶Čøß·“Ó¦ĖŁĀŹæģ,A×Ŗ»ÆĀŹŌö“ó;(4)øł¾ŻĪļÖŹµÄĮæµÄ±ä»ÆÅŠ¶Ļ·“Ó¦ĪļŗĶÉś³ÉĪļ,øł¾ŻĪļÖŹµÄĮæµÄ±ä»ÆÖ®±ČµČÓŚ»Æѧ¼ĘĮæŹżÖ®±ČŹéŠ“·½³ĢŹ½”£
£Ø1£©øł¾ŻĶ¼ĻńÖŖ·“Ó¦Īļ×ÜÄÜĮæøßÓŚÉś³ÉĪļµÄ×ÜÄÜĮ棬ĖłŅŌøĆ·“Ó¦ĪŖ·ÅČČ”£“š°ø£ŗ·ÅČČ”£
£Ø2£©¢Ł¼ÓĖ®,Ļ”ŹĶĮĖŃĪĖįµÄÅضČ,¹Ź·“Ó¦ĖŁĀŹ±äĀż£¬²»·ūŗĻ£»¢Ś¼ÓČė¼øµĪ1mol/LHNO3ČÜŅŗ²»»įÉś³ÉĒāĘų¶ųÉś³ÉNO£¬¹Ź²»·ūŗĻ£»¢Ū¼ÓÅØŃĪĖį,ĒāĄė×ÓÅضČŌö“ó,·“Ó¦ĖŁĀŹ¼Óæģ£¬·ūŗĻ£»¢Ü¼ÓČėĢś·Ū,ĢśŹĒ¹ĢĢ壬øıäÓĆĮæ²»Ó°Ļģ»Æѧ·“Ó¦ĖŁĀŹ£¬²»·ūŗĻ£¬¢Ż¼ÓĀČ»ÆÄĘČÜŅŗ,Ļąµ±ÓŚĻ”ŹĶŃĪĖįÅضČ,ĒāĄė×ÓÅØ¶Č½µµĶ,¹Ź·“Ó¦ĖŁĀŹ±äĀż£¬²»·ūŗĻ£»¢ŽµĪ¼ÓĮņĖįĶČÜŅŗ,Ģś°ŃĶÖĆ»»³öĄ“,ŠĪ³ÉŌµē³Ų,¹Ź·“Ó¦ĖŁĀŹ¼Óæģ,ŅņĪŖĢśŹĒ¹żĮæµÄ£¬²śÉśĒāĘųµÄĮæ²»»įøı䣬·ūŗĻ£»¢ßÉżøßĪĀ¶Č,·“Ó¦ĖŁĀŹ¼Óæģ£¬·ūŗĻ£»¢ąøÄÓĆÅØ¶Č“óµÄŃĪĖį,ĒāĄė×ÓÅضČŌö“ó,·“Ó¦ĖŁĀŹ¼Óæģ£¬·ūŗĻ£»ĖłŅŌCŃ”ĻīŹĒÕżČ·µÄ”£
£Ø3£©Fe+2HCl= FeCl2+H2![]() ½«“Ė·“Ó¦Éč¼Ę³ÉŌµē³Ų£¬Ģś×öøŗ¼«£¬Ź§µē×Ó·¢ÉśŃõ»Æ·“Ó¦£¬ĶĪŖŌµē³ŲµÄÕż¼«£¬·¢ÉśµÄŹĒ»¹Ō·“Ó¦£¬µē¼«·“Ó¦Ź½ŹĒ2H++2e-=H2”ü£¬ĖłŅŌĶµē¼«ÉĻ·¢ÉśµÄµē¼«·“Ó¦ĪŖ2H++2e-=H2”ü”£
½«“Ė·“Ó¦Éč¼Ę³ÉŌµē³Ų£¬Ģś×öøŗ¼«£¬Ź§µē×Ó·¢ÉśŃõ»Æ·“Ó¦£¬ĶĪŖŌµē³ŲµÄÕż¼«£¬·¢ÉśµÄŹĒ»¹Ō·“Ó¦£¬µē¼«·“Ó¦Ź½ŹĒ2H++2e-=H2”ü£¬ĖłŅŌĶµē¼«ÉĻ·¢ÉśµÄµē¼«·“Ó¦ĪŖ2H++2e-=H2”ü”£
¢ņ£Ø1£©øł¾ŻĶ¼ĻóæÉŅŌÖŖµĄX”¢YµÄĪļÖŹµÄĮæ¼õŠ”,ZµÄĪļÖŹµÄĮæŌö¼Ó,ŌņXŗĶYŹĒ·“Ó¦Īļ,ZŹĒÉś³ÉĪļ,ĒŅ·Ö±šŹĒ0.1mol”¢0.3mol”¢0.2mol,ŅņĪŖ±ä»ÆĮæÖ®±ČµČÓŚĻąÓ¦µÄ»Æѧ¼ĘĮæŹżÖ®±Č,ĖłŅŌĘäĻµŹżÖ®±ČĪŖ0.1mol:0.3mol:0.2mol=1:3:2 ,ĖłŅŌĘä·½³ĢŹ½ĪŖX+3Y![]() 2Z,Ņņ“Ė£¬±¾ĢāÕżČ·“š°øŹĒ: X+3Y
2Z,Ņņ“Ė£¬±¾ĢāÕżČ·“š°øŹĒ: X+3Y![]() 2Z.
2Z.
£Ø2£©¢Łøł¾ŻĘ½¾ł»Æѧ·“Ó¦ĖŁĀŹ¹«Ź½¼ĘĖć, ÓɱķÖŠŹż¾ŻæɼĘĖćXµÄĖŁĀŹĪŖ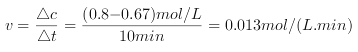 ,ÓÉ·“Ó¦X+3Y
,ÓÉ·“Ó¦X+3Y![]() 2ZÖŖYµÄĖŁĀŹĪŖ0.013 mol/(L.min)
2ZÖŖYµÄĖŁĀŹĪŖ0.013 mol/(L.min)![]() 3= 0.039 mol/(L.min)”£ŹµŃé3ÖŠÓÉ·“Ó¦X+3Y
3= 0.039 mol/(L.min)”£ŹµŃé3ÖŠÓÉ·“Ó¦X+3Y![]() 2ZÖŖ50minŹ±£¬XÅØ¶Č±ä»ÆĮæĪŖ0.6 mol/L£¬ ZµÄÅضČ1.2 mol/L”£Ņņ“Ė£¬±¾ĢāÕżČ·“š°øŹĒ0.039£»1.2 mol/L”£
2ZÖŖ50minŹ±£¬XÅØ¶Č±ä»ÆĮæĪŖ0.6 mol/L£¬ ZµÄÅضČ1.2 mol/L”£Ņņ“Ė£¬±¾ĢāÕżČ·“š°øŹĒ0.039£»1.2 mol/L”£
¢Ś0~20minÄŚ£¬ĘäĖüĢõ¼žŅ»ŃłŹµŃé2ŗĶŹµŃé1µÄ·“Ó¦ĖŁĀŹ²»Ķ¬£¬ĘäŌŅņæÉÄÜŹĒŹµŃé1µÄĪĀ¶ČŹĒ800![]() £¬ŹµŃé2µÄĪĀ¶ČŹĒ900
£¬ŹµŃé2µÄĪĀ¶ČŹĒ900![]() £¬ĖłŅŌŹµŃé2±ČŹµŃé1ĪĀ¶Čøߣ»ŹµŃé3±ČŹµŃé1µÄĪĀ¶ČµĶ£¬µ«·“Ó¦ĖŁĀŹČ“±ČŹµŃé1øߣ¬ĘäŌŅņŹĒŹµŃé3¼ÓČėĮĖ“߻ƼĮ”£“š°ø£ŗŹµŃé2±Č1ĪĀ¶Čøß £»ŹµŃé3¼ÓČėĮĖ“߻ƼĮ”£
£¬ĖłŅŌŹµŃé2±ČŹµŃé1ĪĀ¶Čøߣ»ŹµŃé3±ČŹµŃé1µÄĪĀ¶ČµĶ£¬µ«·“Ó¦ĖŁĀŹČ“±ČŹµŃé1øߣ¬ĘäŌŅņŹĒŹµŃé3¼ÓČėĮĖ“߻ƼĮ”£“š°ø£ŗŹµŃé2±Č1ĪĀ¶Čøß £»ŹµŃé3¼ÓČėĮĖ“߻ƼĮ”£


 ĆūŠ£æĪĢĆĻµĮŠ“š°ø
ĆūŠ£æĪĢĆĻµĮŠ“š°ø
| Äź¼¶ | øßÖŠæĪ³Ģ | Äź¼¶ | ³õÖŠæĪ³Ģ |
| øßŅ» | øßŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” | ³õŅ» | ³õŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” |
| ø߶ž | ø߶žĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õ¶ž | ³õ¶žĆā·ŃæĪ³ĢĶĘ¼ö£” |
| øßČż | øßČżĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õČż | ³õČżĆā·ŃæĪ³ĢĶĘ¼ö£” |
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æøıäĻĀĮŠĢõ¼ž£¬æÉŅŌøı䷓Ӧ»ī»ÆÄܵďĒ
A. Ń¹Ēæ B. ĪĀ¶Č C. ·“Ó¦ĪļÅØ¶Č D. “߻ƼĮ
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æNA±ķŹ¾°¢·ü¼ÓµĀĀŽ³£ŹżµÄÖµ£¬ĻĀĮŠĖµ·ØÕżČ·µÄŹĒ
A. ³£ĪĀĻĀ£¬1mol”ŖOHĖłŗ¬µÄµē×ÓŹżÄæĪŖ9NA
B. ³£ĪĀĻĀ£¬ŌŚ16g 18O2ÖŠŗ¬ÓŠNAøöŃõŌ×Ó
C. 1 molŅŅĶéÖŠŗ¬ÓŠC”ŖHµÄ¼üŹżĪŖ7NA
D. ±ź×¼×“æöĻĀ£¬11.2LSO2Óė×ćĮæO2·“Ӧɜ³ÉSO3·Ö×ÓŹż 0.5NA
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æ25”ꏱ£¬øıä0.1mol/L RCOOHČÜŅŗµÄpH,ČÜŅŗÖŠRCOOH”¢RCOO-µÄĪ¢Į£·Ö²¼·ÖŹża(X)= ![]() ;¼×Ėį(HCOOH)Óė±ūĖį(CH3CH2COOH)ÖŠĖį·Ö×ӵķֲ¼·ÖŹżÓėPHµÄ¹ŲĻµČēĶ¼ĖłŹ¾”£
;¼×Ėį(HCOOH)Óė±ūĖį(CH3CH2COOH)ÖŠĖį·Ö×ӵķֲ¼·ÖŹżÓėPHµÄ¹ŲĻµČēĶ¼ĖłŹ¾”£

ĻĀĮŠĖµ·ØÕżČ·µÄŹĒ
A. ±ūĖįµÄĖįŠŌ±Č¼×ĖįĒæ
B. Čō0.1mol/L¼×ĖįČÜŅŗµÄpH= 2.33,Ōņ0.01mol/L¼×ĖįČÜŅŗµÄpH= 3.33
C. CH3CH2COOH![]() CH3CH2COO-+H+µÄlgK=-4.88
CH3CH2COO-+H+µÄlgK=-4.88
D. ½«0.1mol/LµÄHCOOHČÜŅŗÓė0.lmol/LµÄHCOONaČÜŅŗµČĢå»ż»ģŗĻ,ĖłµĆČÜŅŗÖŠ:c(Na+)>c(HCOOH)>c(HCOO-)>c(OH-)>c(H+)
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æÓŠČēĻĀµÄæÉÄę·“Ó¦£ŗX£Øg£©£«2Y£Øg£©![]() 2Z£Øg£© ĻÖ½«XŗĶYŅŌ1©U2µÄĢå»ż±Č»ģŗĻŌŚĆܱÕČŻĘ÷ÖŠ£¬¼ÓŃ¹µ½3”Į107Pa£¬“ļµ½Ę½ŗāŗó£¬ŅŃÖŖĘ½ŗāדĢ¬Ź±·“Ó¦ĪļµÄ×ÜĪļÖŹµÄĮæŗĶÉś³ÉĪļµÄ×ÜĪļÖŹµÄĮæĻąµČŹ±£¬¶ŌÓ¦Ķ¼ÖŠ×ų±źÉĻµÄĪĀ¶ČŹĒ£Ø £©
2Z£Øg£© ĻÖ½«XŗĶYŅŌ1©U2µÄĢå»ż±Č»ģŗĻŌŚĆܱÕČŻĘ÷ÖŠ£¬¼ÓŃ¹µ½3”Į107Pa£¬“ļµ½Ę½ŗāŗó£¬ŅŃÖŖĘ½ŗāדĢ¬Ź±·“Ó¦ĪļµÄ×ÜĪļÖŹµÄĮæŗĶÉś³ÉĪļµÄ×ÜĪļÖŹµÄĮæĻąµČŹ±£¬¶ŌÓ¦Ķ¼ÖŠ×ų±źÉĻµÄĪĀ¶ČŹĒ£Ø £©
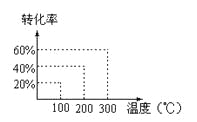
A. 100”ę
B. 200”ę
C. 300”ę
D. ²»ÄÜČ·¶Ø
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æŹµŃ鏱²»Š”ŠÄ½«Č¼×ÅµÄ¾Ę¾«µĘÅöµ¹ŌŚ×ĄÉĻČ¼ÉÕĘšĄ“ĮĖ£¬ÕāŹ±×īŗĻĄķµÄĆš»š·½·ØŹĒ
A.ÓĆŹŖÄز¼ĘĖ»šB.ÓĆŹé±¾ĘĖ“ņC.ÓĆĖ®³åD.ÓĆÅŻÄĆš»šĘ÷ĘĖĆš
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æ¼×»ł±ūĻ©Ėį¼×õ„ŹĒŗĻ³ÉÓŠ»ś²£Į§µÄµ„Ģ唣¾É|·ØŗĻ³ÉµÄ·“Ó¦ŹĒ£ŗ
¢Ł(CH3)2C=O+HCN”ś(CH3)2C(OH)CN
¢Ś(CH3)2C(OH)CN+CH3OH+H2SO4”śCH2=C(CH3)COOCH3+NH4HSO4
ŠĀ·ØŗĻ³ÉµÄ·“Ó¦ŹĒ:¢ŪCH3C”ŌCH+CO+CH3OH![]() CH2=C(CH3)COOCH3
CH2=C(CH3)COOCH3
ĻĀĮŠĖµ·Ø²»ÕżČ·µÄŹĒ
A. ·“Ó¦¢ŚÖŠCH3OHŹĒCH2OHCH2OH(ŅŅ¶ž“¼)µÄĶ¬ĻµĪļ
B. ·“Ó¦¢Ū·ūŗĻĀĢÉ«»ÆѧĖ¼Ļė
C. ¼×»ł±ūĻ©Ėį¼×õ„ÓŠĮ½ÖÖ¹ŁÄÜĶÅ
D. ·“Ó¦¢ŁŹĒ¼Ó³É·“Ó¦
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æ»Æѧ·“Ó¦ÖŠµÄÄÜĮæ±ä»Æ£¬Ķس£Ö÷ŅŖ±ķĻÖĪŖČČĮæµÄ±ä»Æ£®Ä³ŹµŃ銔×éÓĆ0.50mol/L NaOHČÜŅŗŗĶ0.50mol/LĮņĖįČÜŅŗ½ųŠŠÖŠŗĶČČµÄ²ā¶Ø£®²ā¶ØÖŠŗĶČȵďµŃé×°ÖĆČēĶ¼ĖłŹ¾£ŗ
£Ø1£©øĆĶ¼ÖŠÓŠĮ½“¦ŅĒĘ÷Ī“»³ö£¬ĖüĆĒŹĒ”¢ £®
£Ø2£©Š“³öĻ”ĮņĖįŗĶĻ”ĒāŃõ»ÆÄĘČÜŅŗ·“Ó¦±ķŹ¾ÖŠŗĶČȵÄČČ»Æѧ·½³ĢŹ½ĪŖ£ØÖŠŗĶČČŹżÖµĪŖ57.3kJ/mol£© £®
£Ø3£©Č”55mLNaOHČÜŅŗŗĶ25mLĮņĖįČÜŅŗ½ųŠŠŹµŃ飬ŹµŃ鏿¾ŻČē±ķ£®
ŹµŃé“ĪŹż | ĘšŹ¼ĪĀ¶Čt1/”ę | ÖÕÖ¹ĪĀ¶Čt2/”ę | ||
H2SO4 | NaOH | Ę½¾łÖµ | ||
¢Ł | 26.2 | 26.0 | 26.1 | 30.1 |
¢Ś | 27.0 | 27.4 | 27.2 | 33.3 |
¢Ū | 25.9 | 25.9 | 25.9 | 29.8 |
¢Ü | 26.4 | 26.2 | 26.3 | 30.4 |
½üĖĘČĻĪŖ0.50mol/L NaOHČÜŅŗŗĶ0.50mol/LĮņĖįČÜŅŗµÄĆܶȶ¼ŹĒ1g/cm2 £¬ ÖŠŗĶŗóÉś³ÉČÜŅŗµÄ±ČČČČŻc=4.08J/£Øg”ę£©£®ŌņÖŠŗĶČČ”÷H=£ØČ”Š”ŹżµćŗóŅ»Ī»£©£®
£Ø4£©ÓŠ¹ŲÖŠŗĶČČ²ā¶ØŹµŃ飬ĻĀĮŠĖµ·Ø“ķĪóµÄŹĒ
a£®ÓĆĪĀ¶Č¼Ę²ā¶ØNaOHČÜŅŗĘšŹ¼ĪĀ¶ČŗóĀķÉĻÖ±½Ó²ā¶ØH2SO4ČÜŅŗµÄĪĀ¶Č»įµ¼ÖĀÖŠŗĶČČŹżÖµ±Č57.3µĶ
b£®ĪĀ¶Č¼ĘµÄ³åĻ“ŅŗÓ¦µ¹ČėŠ”ÉÕ±²ĪÓė·“Ó¦
c£®»ģŗĻĮņĖįŗĶĒāŃõ»ÆÄĘČÜŅŗŹ±Ó¦·Ö¶ą“Ī°ŃNaOHČÜŅŗµ¹ČėŹ¢ÓŠĮņĖįµÄŠ”ÉÕ±ÖŠ
d£®Čō×°ÖĆĶźČ«ĻąĶ¬£¬²Ł×÷¾łĆ»Ź§Īó£¬Č”110mLNaOHČÜŅŗŗĶ50mLĮņĖįČÜŅŗ½ųŠŠŹµŃ飬Īó²ī±Č55mLNaOHČÜŅŗŗĶ25mLĮņĖįČÜŅŗ½ųŠŠŹµŃéĪó²īŠ”£®
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”潫ĻąĶ¬µÄŠæʬŗĶĶʬ°“Ķ¼Ź¾·½Ź½²åČėĶ¬ÅØ¶ČµÄĻ”ĮņĖįÖŠ£¬ŅŌĻĀŠšŹöÕżČ·µÄŹĒ

A. Į½ÉÕ±ÖŠĶʬ±ķĆę¾łĪŽĘųÅŻ²śÉś B. Į½ÉÕ±ÖŠČÜŅŗµÄH+ÅØ¶Č¶¼¼õŠ”
C. ²śÉśĘųÅŻµÄĖŁĀŹ¼×±ČŅŅĀż D. ¼×ÖŠĶʬŹĒÕż¼«£¬ŅŅÖŠĶʬŹĒøŗ¼«
²éæ““š°øŗĶ½āĪö>>
°Ł¶ČÖĀŠÅ - Į·Ļ°²įĮŠ±ķ - ŹŌĢāĮŠ±ķ
ŗž±±Ź”»„ĮŖĶųĪ„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±ØĘ½ĢØ | ĶųÉĻÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | µēŠÅÕ©Ę¾Ł±Ø×ØĒų | É꥜Ź·ŠéĪŽÖ÷ŅåÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | ÉęĘóĒÖČؾŁ±Ø×ØĒų
Ī„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±Øµē»°£ŗ027-86699610 ¾Ł±ØÓŹĻä£ŗ58377363@163.com