
(18��)������������
��Fe ��ϡ���� �۴��� ��NaOH���� ��FeCl3������Һ ��Fe(OH)3���� ������
��1����NaOH��������_______________������ţ�����Fe(OH)3��������_______________������ţ���
A�������� B������� C������� D���ǵ����
��2���۴������NaOH��ˮ��Һ�з�Ӧ�����ӷ���ʽΪ_______________��
��3���Ѣ�FeͶ���ϡ�����з�����Ӧ�Ļ�ѧ����ʽΪ_______________�����ս�����෨�÷�Ӧ����_______________������ţ���
A��������ԭ��Ӧ B�����ӷ�Ӧ C���û���Ӧ D�����ֽⷴӦ
��4�����Fe(OH)3��������εμӢ�ϡ����Ĺ����пɹ۲쵽��������_______________
��������Ӧ�����ӷ���ʽΪ_______________��
��5���о����������FeCl3������Һ���Fe(OH)3����ļ�����_________________

| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ��2015-2016ѧ�����ʡ�߶���ѧ�����п��Ի�ѧ�Ծ��������棩 ���ͣ�ѡ����
�ϵ�������Ⱦ�����������ܵ���ע�����д����ϵ�ص���ҪĿ���ǣ� ��
A������ʯī�缫
B�����õ����ǵĽ�������
C����ֹ�������й�ĵ��Һ��ʴ������Ʒ
D����ֹ����й����Ӻ�Ǧ���ؽ������Ӷ�������ˮԴ����Ⱦ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2016��ӱ�ʡ������ѧ��12���¿���ѧ�Ծ��������棩 ���ͣ�ѡ����
������ͨ�����з�ɢϵʱ���ܲ��������ЧӦ����( )
A������ˮ B��ʳ��ˮ C������ D��С�մ�ˮ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2015-2016ѧ��㶫ʡ�߶��ϵ������¿���ѧ�Ծ��������棩 ���ͣ�ѡ����
�����������������
A������ȼ�� B������Һ�� C��̼��Ʒֽ� D��Ũ����ϡ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2015-2016ѧ���Ĵ�ʡ�߶��ϵڶ��ζο���ѧ�Ծ��������棩 ���ͣ�ѡ����
ij�߾���ṹ��ʽΪ�� ���䵥�������Ϊ
���䵥�������Ϊ
A��2��4 -����-2-��ϩ
B��2��4-����-1��3-����ϩ
C��2-��-1��3-����ϩ�ͱ�ϩ
D��2-��-1�� 3-���ϩ����ϩ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2016�����ʡ��Ҵ�и����ϵ�һ����Ͽ������ۻ�ѧ�Ծ��������棩 ���ͣ������
����N2��H2����ʵ��NH3�Ĺ�ҵ�ϳɣ������ֿ��Խ�һ���Ʊ����ᣬ�ڹ�ҵ��һ��ɽ�����������������ش��������⣺
��1����֪��N2(g)+O2(g) =2NO(g) ��H=+180.5kJ/mol
N2(g)+3H2(g) 2NH3(g) ��H=��92.4kJ/mol
2NH3(g) ��H=��92.4kJ/mol
2H2(g)+O2(g)=2H2O(g) ��H=��483.6kJ/mol
��NH3����������NO��H2O(g)���Ȼ�ѧ��Ӧ����ʽ�ɱ�ʾΪ�� ��
��2��ij����С���о��������������������£��ı���ʼ�������ʵ���[��n(H2)��ʾ]��N2(g)+3H2(g) 2NH3(g)��Ӧ��Ӱ�죬ʵ�����ɱ�ʾ������ͼ��ʾ�Ĺ��ɣ�ͼ��T��ʾ�¶ȣ�n��ʾ���ʵ�������
2NH3(g)��Ӧ��Ӱ�죬ʵ�����ɱ�ʾ������ͼ��ʾ�Ĺ��ɣ�ͼ��T��ʾ�¶ȣ�n��ʾ���ʵ�������
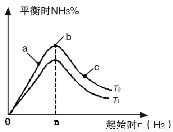
�ٱȽ���a��b��c����������ƽ��״̬�У���Ӧ��N2��ת���������� ��
������ʼʱ��ϵ�м���N2�����ʵ���Ϊ1mol���������ݻ�
Ϊ2L��n=3mol��Ӧ�ﵽƽ��ʱH2��ת����Ϊ60%����������£�T2������Ӧ��ƽ�ⳣ��K= ��
��ͼ����T1��T2�Ĺ�ϵ�ǣ�T1 T2�����>����<����=������ȷ������
��3��������������145��Ϳ�ʼ��Ӧ���ڲ�ͬ�¶Ⱥʹ������������ɲ�ͬ�������ͼ����

4NH3��5O2 4NO��6H2O ��
4NO��6H2O ��
4NH3��3O2 2N2��6H2O
2N2��6H2O
�¶Ƚϵ�ʱ������ Ϊ�����¶ȸ���900��ʱ��NO�����½���ԭ�� ��
��4��N2O5��һ�������������������ʺ��Ʊ��ܵ����ǵĹ�ע��
��һ���¶��£��ں����ܱ�������N2O5�ɷ������з�Ӧ��
2N2O5(g)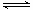 4NO2(g)��O2(g) ��H��0���±�Ϊ��Ӧ��T1�¶��µIJ���ʵ�����ݣ�
4NO2(g)��O2(g) ��H��0���±�Ϊ��Ӧ��T1�¶��µIJ���ʵ�����ݣ�
t/s | 0 | 500 | 1000 |
c(N2O5)/mol��L��1 | 5.00 | 3.52 | 2.48 |
��500s��NO2���������ʿɱ�ʾΪ____________________��
�����������˵���÷�Ӧ�Ѵ�ƽ��״̬���� ��
A����λʱ��������2mol NO2��ͬʱ������lmol N2O5 B������������ɫ���ٷ����仯
C�����������ܶȱ��ֲ��� D���ھ��Ⱥ��ݵ������У���Ӧ��ƽ�ⳣ�����ٱ仯
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2015-2016ѧ�꽭��ʡ�߶���12���¿���ѧ�Ծ��������棩 ���ͣ�ѡ����
��֪��25��ʱ��FeS��CuS���ܶȻ�����(Ksp)�ֱ�Ϊ6.3��10��18��1.3��10��36.����ʱ�����й�˵����ȷ����
A����H2S�ı�����Һ��ͨ������SO2������Һ��������ǿ
B����������CuSO4�ܽ���0.1 mol/L��H2S��Һ�У���Һ��Cu2�������Ũ��Ϊ1.3��10��35 mol/L
C����ΪH2SO4��ǿ�ᣬ���Է�Ӧ��CuSO4��H2S===CuS����H2SO4���ܷ���
D����ȥ��ҵ��ˮ�е�Cu2������ѡ��FeS��������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2015-2016ѧ��㶫ʡ�����и�һ��ѧ�ڵ������¿���ѧ�Ծ��������棩 ���ͣ�ѡ����
��NA��ʾ�����ӵ�������ֵ������������ȷ����
A��1.8g��NH4+ �����к��еĵ�����0.1NA
B��25�棬1.01��105Pa��64gSO2�к��е�ԭ����Ϊ3 NA
C���ڳ��³�ѹ�£�11.2LCl2���еķ�����Ϊ0.5 NA
D����״���£�11.2LH2O�к��еķ�����ĿΪ0.5NA
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com