
分析 (1)原电池中较活泼的金属做负极,负极发生氧化反应、正极发生还原反应;
(2)D上发生还原反应,则D为正极,;
(3)在原电池中,正极发生还原反应得到气体;正极生成的气体为氢气,根据n=$\frac{V}{{V}_{m}}$=$\frac{N}{{N}_{A}}$计算;
(4)根据原电池的应用知识来判断金属的活泼性强弱;
(5)A.原电池和电解池的反应一定为氧化还原反应;
B.充电和放电是电池反应向不同方向进行的过程;
C.根据充电电池可以循环利用分析;
D.充电电池有使用寿命,不是无限制地反复充电、放电;
E.充电时为电解池,将电能转化为化学能;
F.原电池负极失去电子发生氧化反应.
解答 解:(1)把A、B用导线连接后同时浸入稀硫酸溶液中,A上有气泡产生,所以A是正极、B是负极,B极上发生氧化反应;A为正极,正极上氢离子得到电子生成氢气,电极反应为:2H++2e-=H2↑,
故答案为:氧化;2H++2e-=H2↑;
(2)把C、D用导线连接后同时浸入稀硫酸溶液中,D发生还原反应,所以D是正极,C是负极,C的活泼性必须大于Cu,选项中只有c(Ag)不满足,
故答案为:c;
(3)根据①可知金属活泼性顺序为B>A,根据②可知金属活泼性顺序为C>D,根据③可知金属活泼性顺序为A>C,所以金属活泼性顺序为:B>A>C>D,如果把B、D用导线连接后同时浸入稀H2SO4溶液,则D为正极,则D电极上有气泡产生;D电极发生反应为:2H++2e-=H2↑,标况下33.6L氢气的物质的量为:$\frac{33.6L}{22.4L/mol}$=1.5mol,根据电子守恒生成1.5mol氢气转移电子的物质的量为:1.5mol×2=3mol,则导线上转移的电子数目为3NA或1.806×1024,
故答案为:D;3NA或1.806×1024;
(4)根据①可知金属活泼性顺序为B>A,根据②可知金属活泼性顺序为C>D,根据③可知金属活泼性顺序为A>C,所以上述四种金属的活动性顺序由弱到强的是:D<C<A<B,
故答案为:D<C<A<B;
(5)A.充电电池的化学反应有化合价的变化,一定为氧化还原反应,故A正确;
B.充电和放电是电池反应向不同方向进行的过程,即充电是使放电时的氧化还原反应逆向进行,故B正确;
C.充电电池可以循环利用,所以比一次性电池更经济实用,故C正确;
D.充电电池属于二次电池,但并不是可以无限制地反复充电、放电,故D错误;
E.充电时是将电能转化为化学能,故E正确;
F.电池工作时,负极失去电子发生氧化反应,正极得到电子发生还原反应,故F错误;
故答案为:DF.
点评 本题考查电解池与原电池工作原理的综合应用,题目难度中等,明确工作原理为解答关键,试题知识点较多,充分考查了学生的分析能力及综合应用能力.


 考前必练系列答案
考前必练系列答案科目:高中化学 来源: 题型:选择题
| A. | 大力发展电动车,减少燃油汽车的尾气排放量 | |
| B. | 开发利用各种新能源,减少对化石燃料的依赖 | |
| C. | PM2.5含有的铅、镉、铬、钒、砷等对人体有害的元素均是金属元素 | |
| D. | 多环芳烃是强致癌物,能吸附在PM2.5的表面进入人体 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
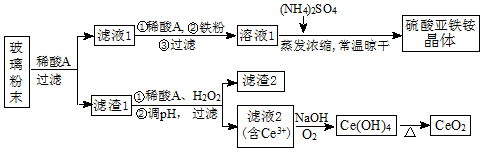
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
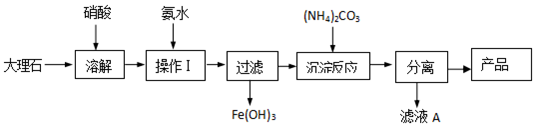
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铝片与稀盐酸反应 | B. | 灼热的炭与水蒸气的反应 | ||
| C. | Ba(OH)2•8H2O与NH4Cl反应 | D. | 甲烷在氧气中的燃烧反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H2RO3 | B. | H2RO4 | C. | HRO3 | D. | HRO4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. |  | B. |  | C. | 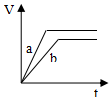 | D. | 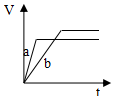 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | C2H4O2 | B. | C3H6O3 | C. | C4H6O4 | D. | C6H12O6 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com