
某研究性学习小组为确定某纯净碱式碳酸镁样品的组成,设计出了下图所示的实验装置(图中A至D的部分)。[已知碱式碳酸镁Mgx(OH)y(CO3)z(x、y、z为正整数)加热能分解生成氧化镁、水和二氧化碳]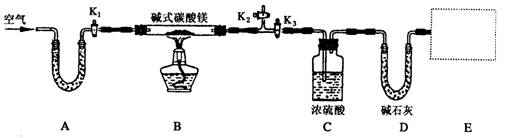
(1)按上图(夹持仪器未画出)组装好实验装置后,应首先进行的操作是__________;A处U形管盛放的药品是__________________,其作用为_______________________。
(2)指导老师在审阅设计方案后指出需要在E处增加一装置,你认为该装置应该是_____________________________.
(3)加热前需要向该装置缓缓鼓入空气数分钟,其目的是___________________;此时对活塞的操作方法是:打开活塞____________________,关闭活塞_________________。
(4)关闭活塞K1、K2,打开K3,加热一段时间后,同学们发现C处洗气瓶中几乎没有气泡冒出,这是由于_________________________。
(5)反应完全后,打开K1,再缓缓鼓入空气数分钟,其目的是_____________________。
(6)实验测得数据如下:碱式碳酸镁样品22.6 g;反应前C装置的质量为87.6 g,反应后质量为89.4 g;反应前D装置的质量为74.7 g,反应后质量为83.5 g。请计算推导该碱式碳酸镁的化学式______________________,该碱式碳酸镁受热分解的化学方程式为____________。
 全能测控期末小状元系列答案
全能测控期末小状元系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源:2013-2014学年安徽省蚌埠市三县联谊校高三第二次联考理综化学试卷(解析版) 题型:实验题
某研究性学习小组的同学为验证浓硫酸与铜能反应而稀硫酸不能,设计了如图所示装置进行探究:将6.4 g 铜片和含0.2 moL溶质的18.4 mol/L浓硫酸放在圆底烧瓶中共热,直到无气体生成为止。(假定在此过程溶液体积不变)

(1)甲同学认为要证实上述结论,还应进行稀硫酸与铜片混合加热实验,你认为有无必要,并说明理由:________________
(2)下列试剂中能够用来进一步证明反应结束后的烧瓶中确有余酸的是:_____
A.铁粉 ?????? B.钠 ???? ?? C.氯化钡溶液 ???????? D.银粉
(3)为定量测定余酸的物质的量浓度,甲、乙两位同学进行了如下设计:
Ⅰ甲同学设想:在A装置增加一个导管通氮气驱赶气体(假定生成的气体全部逸出),先测定生成的SO2的量,然后计算剩余硫酸的浓度。他设计了如下二种方案来测定SO2的量:
方案① 将产生的气体缓缓通入足量用稀硫酸酸化的KMnO4溶液,再加入足量BaCl2溶液,过滤、洗涤、干燥、称量沉淀。
方案② 将气体缓缓通入足量硝酸钡溶液中,然后过滤、洗涤、干燥、称量沉淀。
经仔细分析后,发现有不合理之处,请填写下表(可以不填满):
序号 | 不合理的原因 | 误差 (偏低或偏高) | 改变措施 |
方案① |
|
|
|
方案② |
|
|
|
Ⅱ乙学生设计的方案是:分离出反应后的溶液并加蒸馏水稀释至1000 mL,取20.00 mL于锥形瓶中,滴入2~3滴酚酞指示剂,用标准NaOH溶液进行滴定(已知氢氧化铜开始沉淀的pH约为5),这种方法能否求出余酸的浓度,理由是_______________________________________。
(4)请再设计其他可行的实验方案,来测定余酸的物质的量浓度,简要写出操作步骤及需要测定的数据(不必计算,不必写操作细节)_____________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
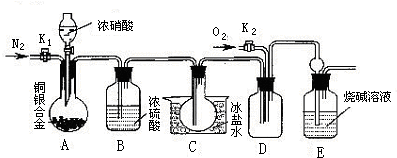
某研究性学习小组验证浓硝酸与铜银合金反应时除生成NO2气体外还会生成少量的NO气体。查阅资料得知:常温下NO2与N2O4混合存在,在低于0℃时几乎只有无色的N2O4液体或晶体存在。为此,他们设计了如下图所示的验证实验装置(图中略去了次要装置)
![]()
![]() 请回答下列问题:
请回答下列问题:
![]() (1)写出A瓶中铜与硝酸可能发生的反应方程式:
(1)写出A瓶中铜与硝酸可能发生的反应方程式:
![]() 、 。
、 。
![]() (2)实验开始时要先打开A中的活塞K1,持续通一段时间的氮气再关闭K1,这样做的目的是 ;装置中B瓶的作用是 。
(2)实验开始时要先打开A中的活塞K1,持续通一段时间的氮气再关闭K1,这样做的目的是 ;装置中B瓶的作用是 。
![]() (3)A中的反应停止后,打开D中的活塞K2,并通入氧气,若反应确有NO气体产生,则D中应出现的现象是 ;实验发现,通入氧气温度的高低对实验现象有较大影响,为了便于观察应通入 (填“冷”或“热”)的氧气。
(3)A中的反应停止后,打开D中的活塞K2,并通入氧气,若反应确有NO气体产生,则D中应出现的现象是 ;实验发现,通入氧气温度的高低对实验现象有较大影响,为了便于观察应通入 (填“冷”或“热”)的氧气。
![]() (4)已知合金的质量为ag,且合金完全溶解。若还想测定铜的质量分数,只需利用A装置中反应后的溶液进行简单的实验操作就可以过到目的,其实验过程为: 。
(4)已知合金的质量为ag,且合金完全溶解。若还想测定铜的质量分数,只需利用A装置中反应后的溶液进行简单的实验操作就可以过到目的,其实验过程为: 。
查看答案和解析>>
科目:高中化学 来源: 题型:
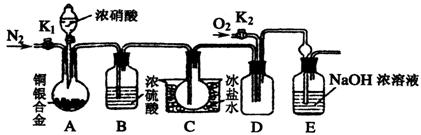
(11分)某研究性学习小组验证浓硝酸与铜银合金反应时除生成NO2气体外还会生成少量的NO气体。查阅资料得知:常温下NO2与N2O4混合存在,在低于0℃时几乎只有无色的N2O4液体或晶体存在。为此,他们设计了如下图所示的验证实验装置(图中略去了次要装置)
请回答下列问题:
(1)写出A瓶中铜与硝酸可能发生的反应方程式:
、 。
(2)实验开始时要先打开A中的活塞K1,持续通一段时间的氮气再关闭K1,这样做的目的是 ;装置中B瓶的作用是 。
(3)A中的反应停止后,打开D中的活塞K2,并通入氧气,若反应确有NO气体产生,则D中应出现的现象是 ;实验发现,通入氧气温度的高低对实验现象有较大影响,为了便于观察应通入 (填“冷”或“热”)的氧气。
(4)已知合金的质量为ag,且合金完全溶解。若还想测定铜的质量分数,只需利用A装置中反应后的溶液进行简单的实验操作就可以过到目的,其实验过程为: 。
查看答案和解析>>
科目:高中化学 来源: 题型:
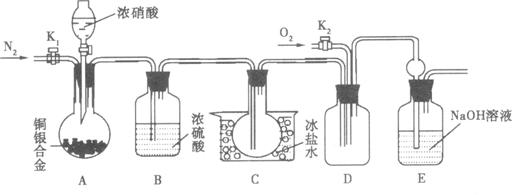
请回答下列问题:
(1)写出A瓶中铜与硝酸可能发生反应的化学方程式;______________________。
(2)实验开始前要先打开A部分的活塞K1,持续通一段时间的氮气再关闭K1,这
样做的目的是______________________________________________;装置中B瓶的作用是____________________________________________________________________。
(3)A中的反应停止后,打开D中的活塞K2,并通入氧气,若反应确有NO产生,则D中应出现的现象是__________________;实验发现,通入氧气温度的高低对实验现象有较大影响,为便于观察应通入___________(填“冷”或“热”)的氧气。
(4)已知合金的质量为a,且合金完全溶解。若还想测定铜的质量分数,只需利用A装置中反应后的溶液进行简单的实验操作就可以达到目的。请简述实验过程:_____________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com