
【题目】下图中横坐标为加入反应物的物质的量,纵坐标为产生沉淀的物质的量。下列选项的编号和曲线的编号一一对应,其中描述错误的是
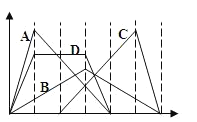
A. 向NaAlO2溶液中逐渐滴入HCl至过量
B. 向澄清石灰水中通入CO2至过量
C. 向含有盐酸的AlCl3溶液中滴入NaOH溶液至过量
D. 向含有等物质的量的Ca(OH)2、KOH的混合溶液中通入CO2至过量
【答案】D
【解析】
A.根据反应AlO2-+H++H2O═Al(OH)3↓,Al(OH)3+3H+═Al3++3H2O判断;
B.根据反应Ca(OH)2+CO2═CaCO3↓+H2O,CaCO3+CO2+H2O═Ca(HCO3)2判断;
C.根据反应H ++OH-=H2O、Al3++3OH-═Al(OH)3↓、Al(OH)3+OH-═AlO2-+2H2O判断;
D.根据反应Ca2++2OH-+CO2═CaCO3↓+H2O、2OH-+CO2═CO32-+H2O、CaCO3+CO2+H2O═Ca(HCO3)2判断。
A.向NaAlO2溶液中滴入HCl至过量,发生的反应分别为AlO2-+H++H2O═Al(OH)3↓,Al(OH)3+3H+═Al3++3H2O,两个反应消耗的盐酸的物质的量之比为1:3,图象符合,故不选A;
B.向澄清石灰水中通入CO2至过量,发生的反应分别为Ca(OH)2+CO2═CaCO3↓+H2O,CaCO3+CO2+H2O═Ca(HCO3)2,两个反应消耗的二氧化硫的物质的量之比为1;1,图象符合,故不选B;
C.向含有盐酸的AlCl3溶液中滴入NaOH溶液至过量,发生的反应分为三个阶段,反应分别为OH-+H+═H20,Al3++3OH-═Al(OH)3↓、Al(OH)3+OH-═AlO2-+2H2O,后两个反应消耗的NaOH的物质的量之比为3:1,图象符合,故不选C;
D.向含有等物质的量的Ca(OH)2、KOH的混合溶液中通入CO2至沉淀消失,分别为Ca2++2OH-+CO2═CaCO3↓+H2O、OH-+CO2═HCO3-+H2O、CaCO3+CO2+H2O═Ca(HCO3)2,则各段反应消耗的二氧化碳的物质的量的比值为1:1:1,故选D;
答案:D


 开心快乐假期作业暑假作业西安出版社系列答案
开心快乐假期作业暑假作业西安出版社系列答案 名题训练系列答案
名题训练系列答案科目:高中化学 来源: 题型:
【题目】下列叙述正确的有( )
①需要通电才可以进行的有:电解、电离、电镀、电泳②水玻璃、福尔马林、天然橡胶、铝热剂都是混合物③![]() 、
、![]() 、
、![]() 均可由化合反应制得④油脂、淀粉、纤维素、天然橡胶都是天然有机高分子化合物⑤“血液透析”和“静电除尘”利用了胶体的同一种性质⑥
均可由化合反应制得④油脂、淀粉、纤维素、天然橡胶都是天然有机高分子化合物⑤“血液透析”和“静电除尘”利用了胶体的同一种性质⑥![]() 、
、![]() 分子中的碳原子均共面⑦铅蓄电池放电结束后,正极电极板的质量在减小
分子中的碳原子均共面⑦铅蓄电池放电结束后,正极电极板的质量在减小
A. 2个B. 3个C. 4个D. 5个
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)2017年中科院某研究团队通过设计一种新型Na-Fe3O4/HZSM-5多功能复合催化剂,成功实现了CO2直接加氢制取辛烷值汽油,该研究成果被评价为“CO2催化转化领域的突破性进展”。
已知:H2(g)+1/2O2(g)=H2O(l) ΔH1 = -aKJ/mol
C8H18(1)+25/2O2(g)=8CO2(g)+9H2O(1) ΔH2= -bKJ/mol
试写出25℃、101kPa条件下,CO2与H2反应生成汽油(以C8H18表示)的热化学方程式_________________________________。
(2)利用CO2及H2为原料,在合适的催化剂(如Cu/ZnO催化剂)作用下,也可合成CH3OH,涉及的反应有:
甲:CO2(g)+3H2(g) ![]() CH3OH(g)+H2O(g) △H= — 53.7kJ·mol-1 平衡常数K1
CH3OH(g)+H2O(g) △H= — 53.7kJ·mol-1 平衡常数K1
乙:CO2(g)+H2(g) ![]() CO(g)+H2O(g) △H= + 41.2kJ·mol-1 平衡常数K2
CO(g)+H2O(g) △H= + 41.2kJ·mol-1 平衡常数K2
①CO(g)+2H2(g) ![]() CH3OH(g)的平衡常数K=______(用含K1、K2的表达式表示),该反应△H_____0(填“大于”或“小于”)。
CH3OH(g)的平衡常数K=______(用含K1、K2的表达式表示),该反应△H_____0(填“大于”或“小于”)。
②提高CO2转化为CH3OH平衡转化率的措施有___________(填写两项)。
③催化剂和反应体系的关系就像锁和钥匙的关系一样,具有高度的选择性。下列四组实验,控制CO2和H2初始投料比均为1:2.2,经过相同反应时间(t1min)。
温度(K) | 催化剂 | CO2转化率(%) | 甲醇选择性(%) | 综合选项 |
543 | Cu/ZnO纳米棒材料 | 12.3 | 42.3 | A |
543 | Cu/ZnO纳米片材料 | 11.9 | 72.7 | B |
553 | Cu/ZnO纳米棒材料 | 15.3 | 39.1 | C |
553 | Cu/ZnO纳米片材料 | 12.0 | 70.6 | D |
由表格中的数据可知,相同温度下不同的催化剂对CO2的转化为CH3OH的选择性有显著影响,根据上表所给数据结合反应原理,所得最优选项为___________(填字母符号)。
(3)以CO、H2为原料合成甲醇的反应为:CO(g)+2H2(g)![]() CH3OH(g)。在体积均为2L的三个恒容密闭容器Ⅰ、Ⅱ、Ⅲ中,分别都充入1molCO和2molH2,三个容器的反应温度分别为T1、T2、T3且恒定不变。下图为三个容器中的反应均进行到5min时H2的体积分数示意图,其中有一个容器反应一定达到平衡状态。
CH3OH(g)。在体积均为2L的三个恒容密闭容器Ⅰ、Ⅱ、Ⅲ中,分别都充入1molCO和2molH2,三个容器的反应温度分别为T1、T2、T3且恒定不变。下图为三个容器中的反应均进行到5min时H2的体积分数示意图,其中有一个容器反应一定达到平衡状态。
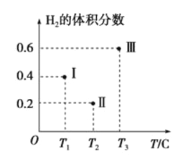
①0~5min时间内容器Ⅱ中用CH3OH表示的化学反应速率为_________________。
②三个容器中一定达到平衡状态的是容器________(填写容器代号)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在容积不变的密闭容器中存在如下反应:2SO2(g)+O2(g)![]() 2SO3(g)△H<0,某研究小组研究了其他条件不变时,改变某一条件对上述反应的影响,下列分析正确的是( )
2SO3(g)△H<0,某研究小组研究了其他条件不变时,改变某一条件对上述反应的影响,下列分析正确的是( )
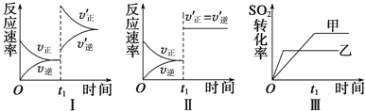
A. 图Ⅰ表示的是t1时刻增大O2的浓度对反应速率的影响
B. 图Ⅱ表示的是t1时刻加入催化剂后对反应速率的影响
C. 图Ⅲ表示的是催化剂对平衡的影响,且甲的催化效率比乙高
D. 图Ⅲ表示的是压强对化学平衡的影响,且乙的压强较高
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式正确的是
A. FeCl3溶液中滴加过量Na2S溶液:2Fe3++S2- =2Fe2++S↓
B. 将Na2O2固体投入H218O中:2Na2O2+2H218O =4Na++4OH-+18O2↑
C. 向NH4Al(SO4)2溶液中滴入Ba(OH)2溶液,恰好使SO42-完全沉淀:NH4++Al3++2SO42-+2Ba2++4OH- = Al(OH)3↓+NH3·H2O+2BaSO4↓
D. 二氧化锰与浓盐酸反应:MnO2+4H++4Cl- ![]() Mn2++2H2O+2Cl2↑
Mn2++2H2O+2Cl2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某厂废水中含5.00×10-3mol·L-1的![]() ,其毒性较大。某研究性学习小组为了变废为宝,将废水处理得到磁性材料
,其毒性较大。某研究性学习小组为了变废为宝,将废水处理得到磁性材料![]() (
(![]() 的化合价依次为+3、+2),设计了如下实验流程:
的化合价依次为+3、+2),设计了如下实验流程:
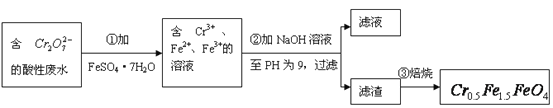
(1)第①步反应的离子方程式是_________________________________________________;
(2)第②步中用pH试纸测定溶液pH的操作是:
______________________________________________________________________________;
(3)第②步过滤得到的滤渣中主要成分除Cr(OH)3外,还有______________________;
(4)欲使1L该废水中的![]() 完全转化为
完全转化为![]() 。理论上需要加入__________g FeSO4·7H2O。
。理论上需要加入__________g FeSO4·7H2O。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以A为原料合成安眠药——苯巴比妥的路线如下:

已知:ⅰ.CH3COOH+SOCl2![]()
![]() +SO2+HCl
+SO2+HCl
ⅱ. 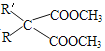 +CO(NH2)2
+CO(NH2)2![]()
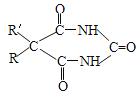 +2CH3OH(R、R为H原子或羟基)
+2CH3OH(R、R为H原子或羟基)
(1)A中官能团的名称是_____。
(2)B→C的化学方程式是_______________________________________。
(3)F为酯,其结构简式是______________________________________。
(4)F→G的反应类型是_________________________________________。
(5)H的结构简式是____________________________________________。
(6)G与CO(NH2)2在一定条件下合成的高分子结构简式是________________。
(7)D的同分异构体有多种,苯环上只有两个取代基且能发生银镜反应的有_____种,写出核磁共振氢谱中氢原子种类数最少的任一种同分异构体的结构简式_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关说法不正确的是
A.根据化合物在水溶液或熔融状态下是否导电,将化合物分为电解质和非电解质
B.氨气的水溶液能够导电,因此NH3是电解质
C.电解质溶液的导电能力与溶液中离子浓度及离子所带电荷多少有关
D.溶液与胶体的本质区别是分散质颗粒直径大小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】从铝土矿(主要成分是Al2O3,含SiO2、Fe2O3、MgO等杂质)中提取氧化铝的两种工艺流程如下:
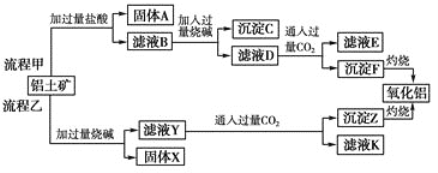
请回答下列问题:
(1) 流程乙加入烧碱后生成SiO32-的离子方程式为________________________________。
(2) 写出由滤液D生成Al(OH)3的离子方程式: ________________________________。
(3)向滤液Y中加入NaHCO3溶液,溶液的pH________(填“增大”、“不变”或“减小”)。
(4) 滤液E、K中溶质的主要成分是________(填化学式)。
(5) 已知298 K时,Mg(OH)2的溶度积常数Ksp=5.6×10-12。取适量的滤液B,加入一定量的烧碱至达到沉淀溶解平衡,测得pH=13.00,则此温度下残留在溶液中的c(Mg2+)=________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com