
(7分)氮是地球上极为丰富的元素
(1)Li3N晶体中氮以N3-的形式存在,基态N3-的电子排布式为 ;
(2)X离子中所有电子正好充满K.L.M三个电子层,它与N3-形成的晶体结构如右图所示。X的元素符号是______,X离子与N3-形成的化合物化学式为______。

(3)水是生命之源,它与我们的生活密切相关。在化学实验和科学研究中,水也是一种常用的试剂。下列是钠、碘、金刚石、干冰、氯化钠晶体的晶胞图(为按顺序排序)。与冰的晶体类型相同的是______(请用相应的编号填写)
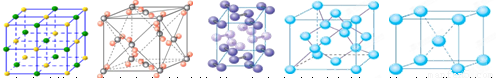
A B C D E
(4)在冰晶体中,每个水分子与相邻的4个水分子形成氢键,已知冰的升华热是51 kJ/mol,除氢键外,水分子间还存在范德华力(11kJ/mol),则冰晶体中氢键的“键能”是 kJ/mol;
1S22S2P6 (1分) Cu, Cu3N(2分) BC(2分) 20(kJ/mol)(2分)
【解析】(1)氮元素的核外电子数是7,所以根据构造原理可知,基态N3-的电子排布式为1S22S2P6。
(2)X离子中所有电子正好充满K.L.M三个电子层,则X离子的核外电子数是28,则是铜元素。所以根据晶胞的结构可知,N3-离子的个数是8×1/8=1,X离子个数是12×1/4=3,所以化学式为Cu3N。
(3)冰形成的晶体是分子晶体,钠是金属晶体,氯化钠是离子晶体,金刚石是原子晶体,碘和干冰形成的晶体都是分子晶体。A是氯化钠,B是干冰,C是碘,D是金刚石,E是金属钠,所以答案选BC。
(4)在冰晶体中,每个水分子与相邻的4个水分子形成氢键,则平均每个水分子形成的氢键是2个,所以氢键键能是(51 kJ/mol-11kJ/mol)÷2=20kJ/mol.


科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
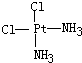 、
、
 、
、
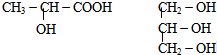
查看答案和解析>>
科目:高中化学 来源: 题型:
| 化学键 | N-N | N=N | N≡N | N-H | H-H |
| 键能/kJ?mol-1 | 159 | 418 | 946 | 391 | 436 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com