
【题目】氨气是一种重要化工原料。
(1)德国化学家哈伯从1902年开始研究由氮气和氢气直接合成氨。
已知:①![]() △H=a kJ/mol
△H=a kJ/mol
②每破坏lmol有关化学键需要的能量如下表:
H-H | N-H | N≡N |
436kJ | 391kJ | 946k |
则a=_________________。
(2)下图为不同温度(T)、不同投料比[n(![]() )/n(
)/n(![]() )]时反应达到平衡时
)]时反应达到平衡时![]() 的转化率变化曲线。
的转化率变化曲线。

①![]() 、
、![]() 、
、![]() 、
、![]() 的大小关系为__________________。
的大小关系为__________________。
②保持温度和体积不变,提高投料比[n(![]() )/n(
)/n(![]() )],则重新达到平衡时,下列说法一定正确的是_______(填字母序号)。
)],则重新达到平衡时,下列说法一定正确的是_______(填字母序号)。
A.![]() 的浓度增大
的浓度增大
B.![]() 的转化率增大
的转化率增大
C.![]() 的体积分数增大
的体积分数增大
D.![]() 的浓度减小
的浓度减小
③温度为![]() 时,向2L密闭容器中加入1.0mol
时,向2L密闭容器中加入1.0mol![]() 和1.0mol
和1.0mol![]() ,若5min后反应达到平衡,则用v(
,若5min后反应达到平衡,则用v(![]() )表示该反应的平均速率为____________________;反应在
)表示该反应的平均速率为____________________;反应在![]() 时的平衡常数K=________________。
时的平衡常数K=________________。
(3)一种新型除烟气中氮氧化物的方法是采用![]() 作还原剂还原烟气中的氮氧化物且产物无污染,写出
作还原剂还原烟气中的氮氧化物且产物无污染,写出![]() 还原
还原![]() 的化学反应方程式_____________________________________。
的化学反应方程式_____________________________________。
(4)若用标准盐酸测定某稀氨水的浓度,应选择__________作指示剂;滴定过程中眼睛注视_____________。已知稀氨水体积为25.0mL,滴定结束测得消耗0.0100mol/L盐酸的平均体积为20.0mL,则该氨水的浓度为________________(保留2位有效数字);若滴定前滴定管尖嘴有气泡,滴定后尖嘴无气泡,则测定结果________(填“偏大”、“偏小”、“不变”)。
【答案】-92kJ/mol ![]() >
>![]() >
>![]() >
>![]() ABD 0.06mol/(L·min) 12.5
ABD 0.06mol/(L·min) 12.5 ![]() 甲基橙 锥形瓶中溶液颜色的变化 0.0080mol/L或8.0×10-3mol/L 偏大
甲基橙 锥形瓶中溶液颜色的变化 0.0080mol/L或8.0×10-3mol/L 偏大
【解析】
(1)△H=反应物总键能-生成物总键能=![]() =-92kJ/mol
=-92kJ/mol
(2)①合成氨正反应是个放热反应,升高温度不利于氨气生成,所以从氨气转化率可以看出![]() >
>![]() >
>![]() >
>![]() ;
;
②保持温度和体积不变,提高投料比[n(H2)/n(N2)],相当于增大氢气浓度,平衡向正反应方向进行,提高氮气的转化率,但自身的转化率会降低,由于体积不变,因此重新达到平衡时氢气的浓度也一定增大,氮气的浓度会降低,由于气体的物质的量也增加,因此平衡时氨气的体积分数不一定增大,答案选ABD;
③温度为![]() 时,向2L密闭容器中加入1.0mol
时,向2L密闭容器中加入1.0mol![]() 和1.0mol
和1.0mol![]() ,若5min后反应达到平衡,
,若5min后反应达到平衡,![]() 转化率为20%,反应在
转化率为20%,反应在![]() 时
时
![]()
起始浓度(mol/L) 0.50.5 0
变化浓度(mol/L) 0.1 0.3 0.2
平衡浓度(mol/L) 0.40.2 0.2
则v(![]() )=
)=![]() =0.06mol/(L·min),平衡常数K=
=0.06mol/(L·min),平衡常数K=![]() =12.5;
=12.5;
(3)一种新型除烟气中氮氧化物的方法是采用NH3作还原剂还原烟气中的氮氧化物且产物无染,因此生成物是氮气和水,则反应的化学反应方程为![]() ;
;
(4)盐酸和氨水恰好反应后溶液呈酸性,可用甲基橙作为指示剂,甲基橙溶液的变色范围是3.1~4.4,当溶液由黄色变为橙色时,可说明达到滴定终点;滴定过程中眼睛注视锥形瓶中溶液颜色的变化;已知稀氨水体积为25.0mL,滴定结束测得消耗0.0100mol/L盐酸的平均体积为20.0mL,则该氨水与盐酸两溶液恰好反应,则说明两溶液中氯化氢和一水合氨的物质的量相等,即氨水浓度为![]() =0.008mol/l;若滴定前滴定管尖嘴有气泡,滴定后尖嘴无气泡,气泡占用实际体积,使体积读数偏大,则测定结果偏大。
=0.008mol/l;若滴定前滴定管尖嘴有气泡,滴定后尖嘴无气泡,气泡占用实际体积,使体积读数偏大,则测定结果偏大。


科目:高中化学 来源: 题型:
【题目】实验室以绿矾(FeSO4·7H2O)为铁源制备补血剂甘氨酸亚铁[(NH2CH2COO)2Fe],有关物质性质如下:
甘氨酸((NH2CH2COOH) | 柠檬酸 | 甘氨酸亚铁 |
易溶于水,微溶于乙醇,两性化合物 | 易溶于水和乙醇,有强酸性和还原性 | 易溶于水,难溶于乙醇 |
实验过程:
Ⅰ.配制含0.10molFeSO4的水溶液。
Ⅱ.制备FeCO3:向配制好的FeSO4溶液中,缓慢加入200mL 1.1mol·L-1NH4HCO3溶液,边加边搅拌,反应结束后过滤并洗涤沉淀。
Ⅲ.制备(NH2CH2COO)2Fe:实验装置如图(夹持和加热仪器已省略),将实验Ⅱ得到的沉淀(过量)和含0.20mol甘氨酸的水溶液混合后加入C中,然后利用A中的反应将C中空气排尽,接着滴入柠檬酸溶液并加热。反应结束后过滤,滤液经蒸发结晶、过滤、洗涤、干燥后得到产品。

回答下列问题:
(1)仪器P的名称是_______。
(2)实验Ⅰ配制FeSO4溶液时,为防止FeSO4被氧化变质,应加入的试剂为_______(填化学式)。
(3)实验Ⅱ中,生成沉淀的离子方程式为_____。
(4)实验Ⅲ中,
①检查装置A的气密性的方法是______。
②柠檬酸可调节pH,体系pH与产率的关系如下表:
实验 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 |
体系pH | 4.0 | 4.5 | 5.0 | 5.5 | 6.0 | 6.5 | 7.0 | 7.5 |
产率/% | 65.74 | 74.96 | 78.78 | 83.13 | 85.57 | 72.98 | 62.31 | 56.86 |
pH过低会使产率下降,其原因是______;柠檬酸的作用还有_____(填字母)。
A.作催化剂
B.作反应终点指示剂
C.促进FeCO3溶解
D.防止二价铁被氧化
③洗涤实验Ⅲ中得到的沉淀,所选用的最佳洗涤试剂是_____(填字母)。
A.热水 B.稀硫酸
C.乙醇 D.柠檬酸溶液
(5)若产品的质量为16.32g,则产率为_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:N2O4(g)![]() 2NO2(g),将装有N2O4和NO2混合气体的烧瓶浸入热水中,烧瓶内混合气体的颜色逐渐变深。下列结论不能说明该反应已经达到化学平衡状态的是
2NO2(g),将装有N2O4和NO2混合气体的烧瓶浸入热水中,烧瓶内混合气体的颜色逐渐变深。下列结论不能说明该反应已经达到化学平衡状态的是
A. 烧瓶内气体的质量不再变化
B. 烧瓶内气体的颜色不再变化
C. 烧瓶内气体的压强不再变化
D. N2O4的消耗速率与NO2的消耗速率之比为1:2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铜及其化合物在人们的日常生活中有着广泛的用途。回答下列问题:
⑴ 铜或铜盐的焰色反应为绿色,该光谱是________(填“吸收光谱”或“发射光谱”)。
⑵ 基态Cu原子中,核外电子占据的最低能层符号是________,其价电子层的电子排布式为___________,Cu与Ag均属于IB族,熔点:Cu________Ag(填“>”或“<”)。
⑶ [Cu(NH3)4]SO4 中阴离子的立体构型是_______;中心原子的轨道杂化类型为_____,[Cu(NH3)4]SO4 中Cu2+与NH3之间形成的化学键称为_______________。
⑷ 用Cu作催化剂可以氧化乙醇生成乙醛,乙醛再被氧化成乙酸,等物质的量的乙醛与乙酸中σ键的数目比为_____________。
⑸氯、铜两种元素的电负性如表:
元素 | Cl | Cu |
电负性 | 3.2 | 1.9 |
CuCl属于________(填“共价”或“离子”)化合物。

⑹Cu 与Cl 形成某种化合物的晶胞如图所示,该晶体的密度为ρ g·cm-3,晶胞边长为a cm,则阿伏加德罗常数为_____(用含ρ、a的代数式表示,相对原子质量:Cu-64,Cl-35.5)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,将![]() mL 1mo/L
mL 1mo/L ![]() 和
和![]() mL 1mo/L
mL 1mo/L ![]() 两种酸溶液分别加水稀释,稀释溶液体积为V,稀释液pH与其体积变化的关系如图所示。下列说法正确的是
两种酸溶液分别加水稀释,稀释溶液体积为V,稀释液pH与其体积变化的关系如图所示。下列说法正确的是
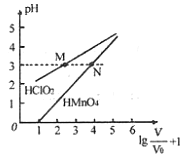
A. ![]() 和
和![]() 均为一元弱酸
均为一元弱酸
B. 在0≤pH≤5时,![]() 溶液满足
溶液满足![]()
C. 分别往M、N两点对应溶液中滴加1 mo/L NaOH溶液至恰好完全反应,消耗NaOH溶液的体积相等
D. 常温下,浓度均为0.1 mo/L的![]() 和
和![]() 溶液,溶液pH:
溶液,溶液pH:![]() >
>![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】合成氨反应过程中的能量变化如图所示,下列说法正确的是

A. 反应体系中加入催化剂,会改变反应的热效应
B. 反应物的总能量低于生成物的总能量
C. 该反应的热化学方程式为3H2(g)+N2(g)![]() 2NH3(g)△H=-QkJ/mol(Q>0)
2NH3(g)△H=-QkJ/mol(Q>0)
D. 该反应是吸热反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设![]() 为阿伏加德罗常数的值。下列叙述正确的是
为阿伏加德罗常数的值。下列叙述正确的是![]()
![]()
A. 标准状况下,22.4LCO和CO2的混合物中,含碳原子的数目为NA
B. 14g分子式为C5H10的烃中,含有的碳碳双键的数目为0.2NA
C. 0.1mol/L的CH3COONH4溶液中,含铵根离子数目小于0.1NA
D. 标准状况下2.24LCl2通入足量水中或NaOH溶液中,转移电子数目为0.1NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,向10 mL0.1 mol/L的HR溶液中逐滴加入0.1 mol/L的氨水,所得溶液pH及导电能力变化如图。下列分析正确的是( )

A. 各点溶液中的离子浓度总和大小关系:d>c > b > a
B. 常温下,R-的水解平衡常数数量级为10 -9
C. a点和b点溶液中,水的电离程度相等
D. d点的溶液中,微粒浓度关系:c(R-)+2c(HR)=c(NH3H2O)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海洋是一个巨大的宝藏,期待着人们的开发和利用。
Ⅰ.(1)利用海水可以得到食盐,从海水中得到食盐的变化是___变化。(填“物理”或“化学”)
(2)要除去某食盐晶体中的CaCl2、MgCl2、Na2SO4等杂质,有以下操作:
A.蒸发结晶 B.过滤 C.加入过量的Na2CO3溶液 D.加水溶解 E.加入过量的烧碱溶液 F.加入过量稀盐酸 G.加入过量的Ba(NO3)2溶液 H.加入过量的稀硝酸 I.加入过量的BaCl2溶液
正确的操作顺序是:__→E→___→C→__→__→A
Ⅱ.海洋植物如海带、海藻中含有丰富的碘元素,碘元素以碘离子的形式存在。实验室里从海藻中提取碘的流程如图所示:

(1)指出提取碘的过程中有关的实验操作名称:①___③___。
(2)操作③中可以选择的有机试剂为___,选择该试剂时,水层在___层(填 “上”或“下”),含碘溶液应从___(获得填“容器上口”或“容器下口”),要从碘的有机溶液中获得碘单质,应采用___的操作(填一种实验操作方法)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com