
| 实验目的 | 实验操作 | |
| A | 区分苯和四氯化碳 | 在两支分别盛有少量苯和四氯化碳的试管中加碘水后振荡 |
| B | 证明溴乙烷中有溴原子 | 溴乙烷与NaOH水溶液共热,充分反应,冷却后加入硝酸银溶液 |
| C | 制取溴苯 | 在苯中加铁粉后再加溴水并振荡 |
| D | 除去苯中的甲苯 | 向混合物中加入酸性高锰酸钾溶液,然后分液 |
| A. | A | B. | B | C. | C | D. | D |
 培优三好生系列答案
培优三好生系列答案 优化作业上海科技文献出版社系列答案
优化作业上海科技文献出版社系列答案科目:高中化学 来源: 题型:解答题
 氢是一种清洁的可再生能源.
氢是一种清洁的可再生能源.| 化学键 | H-H(g) | H-O(g) | O≡O(g) |
| 键能(KJ/mol) | 436 | 463 | 496 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
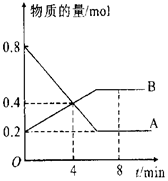 在一定条件下,在4L容器中A、B两种物质间的转化反应中A、B物质的量随时间变化的曲线如图所示,据图分析回答下列问题:
在一定条件下,在4L容器中A、B两种物质间的转化反应中A、B物质的量随时间变化的曲线如图所示,据图分析回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 碱金属元素锂、钠、钾、铷、铯,随着核电荷数的增加其单质的熔沸点逐渐降低 | |
| B. | 卤族元素氟、氯、溴、碘,随着核电荷数的增加其单质的熔沸点逐渐升高 | |
| C. | NaOH、KOH、Mg(OH)2的碱性依次减弱 | |
| D. | 在周期表中金属与非金属的分界处可以找到半导体材料 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 树林晨曦中见到的缕缕阳光,是丁达尔效应效应造成的 | |
| B. | 汽车尾气污染物中含有氮的氧化物,是汽油不完全燃烧造成的 | |
| C. | 神舟11号飞船所用太阳能电池板可将光能转换为电能,所用转换材料是二氧化硅 | |
| D. | 尽量使用含12C的产品,减少使用含13C或14C的产品符合“促进低碳经济”宗旨 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 次氯酸的结构式:H-Cl-O | B. | 1H、2H、3H是同一种核素 | ||
| C. | S2-的结构示意图: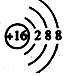 | D. | 四氯化碳的电子式: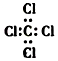 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
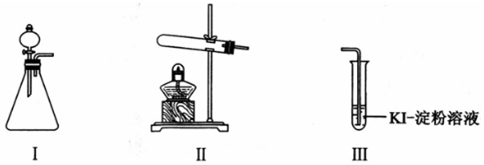
| 操作 | 现象 | |
| 甲 | 向I的锥形瓶中加入MnO2固体,.向I的分液漏斗中加入30% H2O2溶液,连接I、Ⅲ,打开活塞 | I中产生无色气体并伴随大量白雾;Ⅲ中有气泡冒出,溶液迅速变蓝 |
| 乙 | 向Ⅱ中加入KMnO4固体,连接Ⅱ、Ⅲ,点燃酒精灯 | Ⅲ中有气泡冒出,溶液不变蓝 |
| 丙 | 向Ⅱ中加入KMnO4固体,Ⅲ中加入适量0.1mol/L H2SO4溶液,连接Ⅱ、Ⅲ,点燃酒精灯 | Ⅲ中有气泡冒出,溶液变蓝 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com