
【题目】用符号A:质子数,B:中子数,C:核外电子数,D:最外层电子数,E:电子层数,填写下列各空。
(1)原子种类由_____决定。
(2)元素的种类由_____决定
(3)元素的化合价主要由____决定
(4)核电荷数由_____决定。
 世纪百通期末金卷系列答案
世纪百通期末金卷系列答案科目:高中化学 来源: 题型:
【题目】含SO2的烟气会形成酸雨,工业上常利用Na2SO3溶液作为吸收液脱除烟气中的SO2 . 随着SO2的吸收,吸收液的pH不断变化.下列粒子浓度关系一定正确的是( )
A.Na2SO3溶液中存在: ![]()
B.已知NaHSO3溶液pH<7,该溶液中: ![]()
C.当吸收液呈中性时: ![]()
D.当吸收液呈酸性时: ![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】串联电路中四个电解池分别装有0.5molL﹣1的下列溶液,用惰性电极电解,连接直流电源一段时间后,溶液pH最大的是( )
A.KNO3溶液
B.NaCl溶液
C.AgNO3溶液
D.CuCl2溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】a mol FeS与b mol FeO投入到V L、c mol·L-1的硝酸溶液中充分反应,产生NO气体,所得澄清溶液成分可看作是Fe(NO3)3和H2SO4的混合液,则反应中未被还原的硝酸可能为
①(a+b)×63 g ②(a+b)×189 g ③ (Vc-![]() ) mol ④
) mol ④![]() mol
mol
A. ①④ B. ②③ C. ①③ D. ②④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某稀硫酸和稀硝酸的混合溶液200mL,平均分成两份。向其中一份中逐渐加入铜粉,最多能溶解19.2g(已知硝酸只被还原为NO气体)。向另一份中逐渐加入铁粉,产生气体的量随铁粉质量增加的变化如图所示。下列分析或结果不正确的是
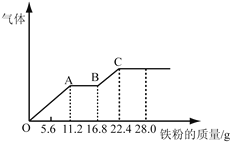
A. 混合酸中HNO3物质的量浓度为2mol/L
B. OA段产生的是NO,AB段的反应为Fe+2Fe3+=3Fe2+,BC段产生氢气
C. 原混合酸中H2SO4物质的量为0.4 mol
D. 第二份溶液中最终溶质为FeSO4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列污水处理的方法中,表示其原理的离子方程式不正确的是( )
A.混凝法,用明矾做混凝剂:Al3++3H2O ![]() Al(OH)3+3H+
Al(OH)3+3H+
B.中和法,用过量CO2中和碱性废水:CO2+2OH-=CO32-
C.沉淀法,用Na2S处理含Hg2+废水:Hg2++S2-=HgS↓
D.氧化还原法,用FeSO4将酸性废水中Cr2O72—还原为Cr3+:Cr2O72—+6Fe2++14H+=2Cr3++6Fe3++7H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(一定温度下,在三个体积约为1.0L的恒容密闭容器中发生反应:2CH3OH(g)═CH3OCH3(g)+H2O(g)
下列说法正确的是( )
容器 | 温度(℃) | 起始物质的量(mol) | 平衡物质的量(mol) | |
CH3OH(g) | CH3OCH3(g) | H2O(g) | ||
I | 387 | 0.20 | 0.080 | 0.080 |
Ⅱ | 387 | 0.40 | ||
Ⅲ | 207 | 0.20 | 0.090 | 0.090 |
A.该反应的正方应为吸热反应
B.达到平衡时,容器I中的CH3OH体积分数比容器Ⅱ中的小
C.容器I中反应达到平衡所需时间比容器Ⅲ中的长
D.若起始时向容器I中充入CH3OH 0.1mol、CH3OCH30.15mol和H2O 0.10mol,则反应将向正反应方向进行
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,向一恒容密闭容器中充入2 mol SO2和1 mol O2,在一定条件下发生反应: 2SO2+O2![]() 2SO3,下列有关说法正确的是( )
2SO3,下列有关说法正确的是( )
A. 当O2的浓度不变时,反应达到平衡状态
B. 达到化学平衡时,正反应和逆反应的速率相等且都为零
C. 当单位时间消耗a mol O2,同时消耗2a mol SO2时,反应达到平衡状态
D. 当SO2、O2、SO3的分子数比为2∶1∶2时,反应达到平衡状态
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在常温下,Fe与水并不起反应,但在高温下,Fe与水蒸气可发生反应。应用下列装置,在硬质玻璃管中放入还原铁粉和石棉绒的混合物,加热,并通入水蒸气,就可以完成高温下“Fe与水蒸气的反应实验”。 请回答该实验中的问题。
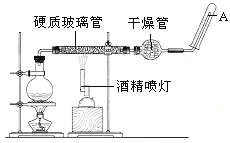
(1)写出该反应的化学方程式__________________________________________。
(2)玻璃管中石棉绒的作用是__________________________________,圆底烧瓶中盛装水,烧瓶里应事先放置_________________,其作用是______________。
(3)该同学欲确定反应后硬质试管中固体物质的成分,设计了如下实验方案:
①待硬质试管冷却后,取少许其中的固体物质溶于稀硫酸得溶液B;
②取少量溶液B滴加KSCN溶液,若溶液变红色则说明硬质试管中固体物质的成分是_______________________,若溶液未变红色则说明硬质试管中固体物质的成分是_______________________。
(4)该同学按上述实验方案进行了实验,结果溶液未变红色,原因是___________________(用离子方程式表示)。
(5)该同学马上另取少量溶液B,使其跟NaOH溶液反应。若按图所示的操作,可观察到生成白色沉淀,迅速变成灰绿色,最后变成红褐色的现象,请写出与上述现象相关的反应的化学方程式_____________________________ ,________________________。
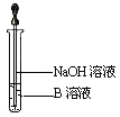
(6)一段时间后,该同学发现(4)中未变红的溶液变成红色,说明Fe2+ 具有____性。由此可知,实验室中含Fe2+的盐溶液需要现用现配制,并且配制含Fe2+的盐溶液时应加入少量____________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com