
 为测定硫酸钠晶体的化学式,取样品32.2g配成100mL溶液,再滴入5mol/L氯化钡溶液,当滴入20mL时恰好不再产生沉淀,试通过计算写出硫酸钠晶体的化学式.
为测定硫酸钠晶体的化学式,取样品32.2g配成100mL溶液,再滴入5mol/L氯化钡溶液,当滴入20mL时恰好不再产生沉淀,试通过计算写出硫酸钠晶体的化学式. 分析 设晶体的化学式为xNa2SO4.yH2O,发生Na2SO4+BaCl2═BaSO4↓+2NaCl,当滴入20mL时恰好不再产生沉淀,消耗n(BaCl2)=0.02L×5mol/L=0.1mol,结合反应及晶体中硫酸钠与水的物质的量比计算.
解答 解:设晶体的化学式为xNa2SO4.yH2O,当滴入20mL时恰好不再产生沉淀,消耗n(BaCl2)=0.02L×5mol/L=0.1mol,
由Na2SO4+BaCl2═BaSO4↓+2NaCl,可知,n(Na2SO4)=0.1mol,
则晶体中水的物质的量为$\frac{32.2g-142g/mol×0.1mol}{18g/mol}$=1mol,
所以x:y=0.1mol:1mol=1:10,
即晶体的化学式为Na2SO4.10H2O,
答:硫酸钠晶体的化学式为Na2SO4.10H2O.
点评 本题考查化学反应方程式的计算,为高考常见题型,把握图象分析及恰好不再生成沉淀时的物质的量关系为解答的关键,侧重分析与计算能力的考查,注意晶体化学式的确定方法,题目难度不大.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | BaCl2→Na2CO3→HCl | |
| B. | 过量的BaCl2→过量的Na2CO3→足量的HCl | |
| C. | 过量的Ba(NO3)2→过量的Na2CO3→HCl | |
| D. | Ba(OH)2→Na2CO3→HCl |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 其原子核内中子数和质子数都是m | |
| B. | 其原子核内中子数为( n-m )个,核外电子数肯定为n个 | |
| C. | 其原子质量与12C原子质量之比约为n:12 | |
| D. | 其原子质量是12C原子质量的n倍 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
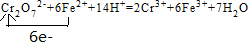 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 蛋白质、纤维素、蔗糖、PVC、淀粉都是高分子化合物 | |
| B. | 使用太阳能热水器、沼气的利用、玉米制乙醇都涉及到生物质能的利用 | |
| C. | 氢键在形成蛋白质二级结构和DNA双螺旋结构中起关键作用 | |
| D. | 石油、煤、天然气、可燃冰、生物柴油都属于化石燃料 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ① | B. | ② | C. | ③ | D. | ①④ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com