
����Ŀ����ͼװ����ʾ��C��D��E��F��X��Y���Ƕ��Ե缫���ס�������Һ�������Ũ�ȶ���ͬ������ͨ��ǰ����Һ������䣩��A��BΪ���ֱ����Դ����������ֱ����Դ��ͨ��F�������ʺ�ɫ�� 
��ش�
��1��B���ǵ�Դ�� �� һ��ʱ�������Һ��ɫ �� ����X����������ɫ��dz��Y����������ɫ�������� �� �ڵ糡��������Y���ƶ���
��2�����ס���װ���е�C��D��E��F�缫��ֻ��һ�ֵ�������ʱ����Ӧ���ʵ����ʵ���֮��Ϊ ��
��3�����ñ�װ�ø�ͭ����������HӦ��������Ʋ�������Ƽ����������Һ����Һ����������Һ��c��OH����=0.1molL��1ʱ����ʱ����Һ���Ϊ500mL�������жƼ���������������Ϊ �� ������Һ��pH��������С�����䡱����
��4������C�缫��Ϊ��������װ�ö����䣬����з����ܷ�Ӧ�����ӷ���ʽ�� ��
���𰸡�
��1����������dz�����������������Ӵ������
��2��1��2��2��2
��3���Ƽ���AgNO3��5.4g����С
��4��Fe+Cu2+ ![]() ?Cu+Fe2+
?Cu+Fe2+
���������⣺��ֱ����Դ��ͨ��F�������ʺ�ɫ��˵��F���Լ��ԣ����������ڸõ缫�ŵ磬����F����������BΪ��Դ������AΪ��Դ�������ɵó�D��F��H��Y��Ϊ������C��E��G��X��Ϊ������
��1.��B�缫�ǵ�Դ�ĸ�������A���У��������ͭ�Ĺ����У�ͭ�������٣�������Һ��ɫ��dz��Y�����������õ缫��ɫ���˵����������������õ缫�ƶ������Ե����������������������������Ӵ�����ɣ����Դ��ǣ���������dz�����������������Ӵ�����ɣ�
��2.��C��D��E��F�缫�����ĵ缫��Ӧ�ֱ�Ϊ��4OH���TO2��+2H2O+4e����Cu2++2e���TCu��2Cl���TCl2��+2e����2H++2e���TH2���������缫ת�Ƶ��Ӿ�Ϊ1molʱ�����ɵ��ʵ����ֱ�Ϊ��0.25mol��0.5mol��0.5mol��0.5mol�����Ե��ʵ����ʵ���֮��Ϊ1��2��2��2�����Դ��ǣ�1��2��2��2��
��3.�����װ���У��Ʋ�����������������Ƽ�������������HӦ���ǶƼ������Һ���жƲ���������ӣ��ʵ��ҺΪAgNO3��Һ����������Һ��c��OH����=0.1molL��1ʱ����ʱ����Һ���Ϊ500mL�������ݵ缫��Ӧ2H2O+2e���TH2��+2OH�� �� ��ŵ�������ӵ����ʵ���Ϊ��0.1mol/l��0.5L=0.05mol����ת��0.05mol����ʱ�����жƼ���������������=108g/mol��0.05mol=5.4g��
�������ͭ�Ĺ�����ˮ�ŵ��������������������ɣ�����������Ũ����������������ǿ��������Һ��pH��С�����Դ��ǣ��Ƽ���AgNO3��5.4g����С��
��4.��C�缫��Ϊ������������ʧ���ӣ�����ͭ���ӵõ��ӣ����ط�ӦΪ��Fe+Cu2+ ![]() Cu+Fe2+ �� ���Դ��ǣ�Fe+Cu2+
Cu+Fe2+ �� ���Դ��ǣ�Fe+Cu2+ ![]() Cu+Fe2+ ��
Cu+Fe2+ ��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����������Ϣ��ѧ����Դ��ѧ��һ����Ҫ����,��������оƬ��̫���ܵ�صȡ���������ͼ�ǹ�ҵ����ȡ�����һ�ַ���:
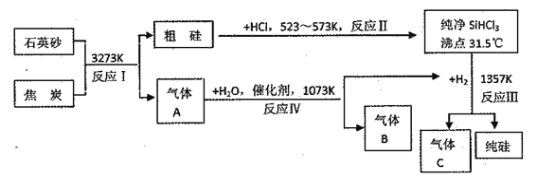
��ش���������
��1����ӦI�Ļ�ѧ����ʽΪ______________________�����������������г���ӦI�����û���Ӧ����________________________(�Ӧ�Ĵ��š�I��IV")��
��2��A��B��C��������,�ڡ����ܼ��š���������Ŀ���һ��������________��(д��ѧʽ)
��3���������ǿ�Ӧ�ų�����,�仯ѧ����ʽΪ_______________________________��
��4����ҵ�Ϻϳɰ���ԭ��H2���Ƚ���̿��ˮ������Ӧ����ˮú��,���ᴿˮú���õ�������H2,��ҵ���Ƶô���H2�Ļ�ѧ����ʽΪ_________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij��ˮ�к���CN-��Cr2O72-���������辭��ˮ��������С���ŷ�����ˮ����������������̽��д���:

�ش���������:
��1������������CN-��ClO-����ΪCNO-�����ӷ���ʽΪ____________��
��2���������ķ�Ӧ�����˷���ʽΪS2O32-+Cr2O72-+H+��SO42-+Cr3++H2O(δ��ƽ)��ÿ����0.4mol Cr2O72-ʱ����Ӧ��S2O32-ʧȥ_________mol���ӡ�
��3����Cr3+��ˮ���Լ�����ʯ�ҽ�һ��������Ŀ����___________________��
���𰸡� CN��+ClO�� = CNO��+Cl�� 2.4 ���ڷ�ˮpH��ʹ��ת��ΪCr(OH)3������ȥ
����������1��������У�CN-��ClO-����ΪCNO-����Ϊ���ڼ��Ի����У�����ClO��ֻ�ܱ���ԭΪCl������˷�Ӧ�����ӷ���ʽΪCN��+ClO�� = CNO��+Cl������2�����ݷ���ʽ��֪���ڷ�Ӧ��CrԪ�صĻ��ϼ۴ӣ�6�۽��͵���3�ۣ��õ�3�����ӣ�����0.4 mol Cr2O72-ת��ΪCr3��ʱת�Ƶ��ӵ����ʵ�����0.4mol����6��3����2��2.4mol����3����ʯ����ǿ�����ˮ�Լ��ԣ����Ժ�Cr3+��ˮ�м�����ʯ�ҽ�һ��������Ŀ���ǵ��ڷ�ˮpH��ʹ��ת��ΪCr(OH)3������ȥ��
�����͡�������
��������
30
����Ŀ����ʪ��������ĸ���Ʒ������(H2SiF6)������ˮ������Ĺ�����ͼ��ʾ:

��֪�������(K2SiF6)����,����ʪ�ԣ�����ˮ,�����ھƾ���
��1��д����Ӧ���еĻ�ѧ����ʽ:________________��
��2����ʵ���ҹ��˲��������õIJ���������_____________����ϴ�ӷ������(K2SiF6)ʱ���þƾ�ϴ��,��Ŀ����:____________��
��3������������Щ���ʿ���ѭ��ʹ��:_____________��(�û�ѧʽ����)
��4����������Ը�ʴ�̻��������ڿ�ʴ����������Ҳ������H2SiF6,��д���÷�Ӧ�Ļ�ѧ����ʽ:__________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����������У���ȷ����
A����״���£�Cl2��Ħ������Ϊ71g
B��������ԭ��Ӧһ������Ԫ�زμ�
C�������Ϲ涨��0.012kg 12C�����е�̼ԭ����ԼΪ1mol
D��Na2CO3�������Σ�������̼�������ý�����෨�����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ȥ���������������Լ��ͷ�������ȷ���ǣ�������
A. KNO3��NaCl�������ᾧ
B.ˮ���ƾ���������Һ
C.Cu��Fe�����������������ᣬ����
D. CO2��HCl����������̼��������Һ��ϴ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������Һ���е����������ʵ���Ũ�������ǣ�������
A.2mL0.2mol/LNaCl��ҺB.1mL0.2mol/LKCl��Һ
C.1mL0.2mol/LCaCl2��ҺD.1mL0.1mol/LAlCl3��Һ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼ��ʾΪ�����������ṹ��ͼ�������ཻ����A��B��C��D ��ʾ���ʼ�ķ�Ӧ�����ж�Ӧ���ַ�Ӧ�����ӷ���ʽ��д����ȷ����
![]()
A��Cl2��2OH��=Cl����ClO����H2O
B��Cu2����2OH��=Cu(OH)2��
C��Cu2����SO42-��Ba2����2OH��=BaSO4����Cu(OH)2��
D��OH����HCO3-=H2O��CO32-
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������˵������ȷ����
A.���������˵Na2SO4�����Ρ������Ρ�����B.��������ָ����������
C.��ͼ��ж�����Ԫ��D.�������ʵ������Ǵ�����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��M2O7x�����Ӻ�S2����������Һ�з�����Ӧ��M2O7x��+3S2��+14H+=2M3++3S��+7H2O����M2O7x��������M�Ļ��ϼ��ǣ� ��
A. +2 B. +3 C. +4 D. +6
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com