
| A. | 4:11 | B. | 16:9 | C. | 8:11 | D. | 32:9 |
分析 由反应中R和M的质量比为11:9,由生成M的质量计算出物质R的质量;再利用质量守恒定律,计算出参加反应X的质量,从而求得参加反应的X与生成的R的质量比.
解答 解:由32gY与X恰好完全反应后,生成18gM,且生成的R和M的质量比为11:9,反应生成R的质量=$\frac{11}{9}$×18g=22g,
根据质量守恒定律,参加反应的X的质量=18g+22g-32g=8g;
则在此反应中,参加反应的X与生成的R的质量比=8g:22g=4:11.
故选A.
点评 本题考查了化学方程式的计算,题目难度不大,注意掌握质量守恒定律的内容及应用方法,试题侧重基础知识的考查,培养了学生的分析能力及化学计算能力.


 优学名师名题系列答案
优学名师名题系列答案科目:高中化学 来源: 题型:实验题
| 溶液 | A | B | C | D |
| 加入盐酸后的现象 | 无明显变化 | 无明显变化 | 有气泡产生 | 无明显变化 |
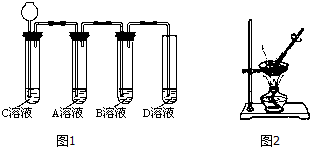
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 已知反应2H2(g)+O2(g)═2H2O(g)的能量变化如图所示,下列说法正确的是( )
已知反应2H2(g)+O2(g)═2H2O(g)的能量变化如图所示,下列说法正确的是( )| A. | 2mol氢气与1mol氧气的总能量为1368kJ | |
| B. | 形成1molH-O键需要吸收463kJ的能量 | |
| C. | 氢气与氧气反应的热化学方程式为2H2+O2═2H2O△H=-484kJ•mol-1 | |
| D. | 1mol氢气与0.5mol氧气反应生成1mol液态水放热大于242kJ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
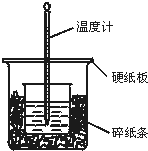 50mL 0.50mol/L盐酸与50mL 0.55mol/L NaOH溶液在如图所示的装置中进行中和反应.通过测定反应过程中所放出的热量可计算中和热.回答下列问题:
50mL 0.50mol/L盐酸与50mL 0.55mol/L NaOH溶液在如图所示的装置中进行中和反应.通过测定反应过程中所放出的热量可计算中和热.回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 如图是以Zn和Cu为电极,稀H2SO4为电解质溶液形成的原电池,某实验兴趣小组做完实验后,在读书卡片上记录如下:
如图是以Zn和Cu为电极,稀H2SO4为电解质溶液形成的原电池,某实验兴趣小组做完实验后,在读书卡片上记录如下:| ①Zn为正极,Cu为负极; ②H+向负极移动; ③Cu极有H2产生; ④电子流动方向Zn→G→Cu; ⑤正极的电极反应式是Zn-2e-=Zn2+: ⑥若有1mol电子流过导线,则理论上产生0.5mol H2. |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 硫酸和醋酸反应时放出氢气一样多 | B. | 反应后醋酸溶液中锌粉有剩余 | ||
| C. | 稀释后溶液中的c(H+)硫酸比醋酸大 | D. | 反应开始时醋酸中的反应速率大 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com