
分析 ①CN-与S2O32-反应生成两种离子,一种与Fe3+可生成红色弱电解质,该离子为SCN-;另一种与H+作用产生能使品红溶液腿色的刺激性气体,该气体为二氧化硫,生成的另一种离子为SO32-,据此写出反应的离子方程式;
②用过氧化氢处理NaCN可生成可溶性碳酸盐和氨,碳酸盐为碳酸钠,CN-只能存在与碱性溶液,据此写出该反应的离子方程式;
③碱性条件下用氯气氧-化CN-生成可溶性碳酸盐和一种空气中主要气体,气体为氮气.
解答 解:)①CN-与S2O32-反应生成两种离子,一种与Fe3+可生成红色弱电解质,该离子为SCN-;另一种与H+作用产生能使品红溶液腿色的刺激性气体,该气体为二氧化硫,生成的另一种离子为SO32-,该反应的离子反应方程式为:CN-+S2O32-=SCN-+SO32-,
故答案为:CN-+S2O32-=SCN-+SO32-;
②用过氧化氢处理NaCN可生成可溶性碳酸盐和氨,碳酸盐为碳酸钠,CN-只能存在与碱性溶液,则该溶液一定为碱性溶液,所以该反应的离子方程式为:H2O2+CN-+OH-=CO32-+NH3,
故答案为:H2O2+CN-+OH-=CO32-+NH3;
③碱性条件下用氯气氧-化CN-生成可溶性碳酸盐和一种空气中主要气体,气体为氮气,则该反应的离子反应方程式为:5Cl2+12OH-+2CN-=10Cl-+2CO32-+6H2O+N2↑,
故答案为:5Cl2+12OH-+2CN-=10Cl-+2CO32-+6H2O+N2↑.
点评 本题考查了离子方程式的书写,为高考的高频题,题目难度中等,明确离子方程式的书写原则为解答关键,试题侧重考查学生的分析、理解能力及灵活应用能力.


 智慧课堂密卷100分单元过关检测系列答案
智慧课堂密卷100分单元过关检测系列答案 单元期中期末卷系列答案
单元期中期末卷系列答案科目:高中化学 来源: 题型:选择题
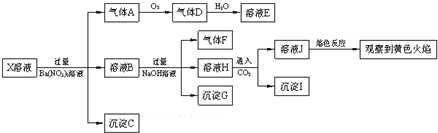
| A. | X中肯定存在Na+、Fe2+、A13+、NH4+、SO42- | |
| B. | 气体F在足量氧气中经催化氧化不可直接生成气体D | |
| C. | 沉淀C一定是BaSO4、沉淀G一定是Fe(OH)3、沉淀I一定是Al(OH )3 | |
| D. | X中不能确定的离子是Fe2+、SO32-、K+和C1- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氢氧化铜与盐酸; 氢氧化铜与醋酸 | |
| B. | 氯化钡溶液与硫酸铜溶液; 氢氧化钡溶液与硫酸铜溶液 | |
| C. | 碳酸氢钠溶液与稀硫酸 碳酸钠溶液与稀硫酸 | |
| D. | 石灰石与稀硝酸 石灰石与稀盐酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
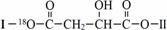 (其中Ⅰ、Ⅱ为未知部分的结构).下列是X发生反应的转化关系图及E的信息.
(其中Ⅰ、Ⅱ为未知部分的结构).下列是X发生反应的转化关系图及E的信息.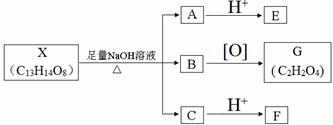
 .
.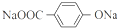 ;X的结构简式是
;X的结构简式是 .
.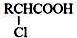 ;RCH2Br$→_{②H_{2}O/H+}^{①NaCN}$RCH2COOH
;RCH2Br$→_{②H_{2}O/H+}^{①NaCN}$RCH2COOH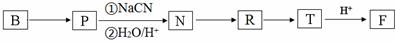
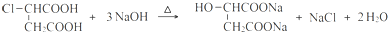 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 容量瓶、量筒和滴定管上都标有使用温度,量筒、容量瓶无“0”刻度,滴定管有“0”刻度;使用时滴定管水洗后还需润洗,但容量瓶水洗后不用润洗 | |
| B. | 2014 年西非国家爆发了埃博拉疫情,埃博拉病毒对化学药品敏感,乙醇、次氯酸钠溶液均可以将病毒氧化而达到消毒的目的 | |
| C. | 金属着火时,可用细沙覆盖灭火;电器设备引起的火灾,不可用泡沫灭火器灭火 | |
| D. | 在4mL0.1mol•L-1的K2Cr2O7溶液中滴加数滴1mol•L-1的NaOH溶液,溶液颜色从橙色变成黄色 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
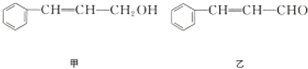
| 分子式 | C14H14O2 |
| 部分性质 | 能使Br2/CCl4褪色 |
| 能在稀H2SO4中水解 |
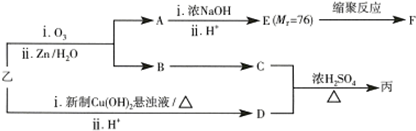
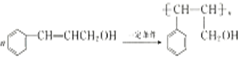 .
.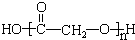 .
.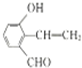 .
.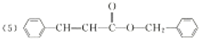 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com