
| A. | pH=11的NaOH溶液与pH=3的醋酸溶液等体积混合,滴入石蕊溶液呈红色 | |
| B. | 在稀溶液中,H+(aq)+OH-(aq)═H2O(l)△H=-57.3kJ•mol-1,若将含0.5molH2SO4的浓硫酸与含1mol NaOH的溶液混合,放出的热量大于57.3 kJ | |
| C. | Zn 具有还原性和导电性,可用作锌锰干电池的负极材料 | |
| D. | 由2 mol H原子形成1 mol H-H键要吸收热量 |
分析 A.醋酸为弱酸,混合液中醋酸过量,溶液呈酸性,石蕊试液遇到酸呈红色;
B.浓硫酸溶于水放热,则该反应中放出的热量增大;
C.Zn为叫活泼金属,则锌锰干电池中锌为负极;
D.化学反应中,旧键断裂吸收能量,新键形成放出热量.
解答 解:A.pH=11的NaOH溶液与pH=3的醋酸溶液等体积混合,溶液呈酸性,则滴入石蕊溶液呈红色,故A正确;
B.在稀溶液中H+(aq)+OH-(aq)═H2O(l)△H=-57.3kJ•mol-1,说明该中和反应中生成1mol液态水放出57.3kJ热量;由于浓硫酸溶于水放热,则将含0.5molH2SO4的浓硫酸与含1mol NaOH的溶液混合,放出的热量大于57.3 kJ,故B正确;
C.Zn具有还原性和导电性,在锌锰干电池中,负极材料为金属Zn,故C正确;
D.新键形成过程放热,则2 mol H原子形成1 mol H-H键要放出热量,故D错误;
故选D.
点评 本题考查了反应热与焓变、原电池工作原理,题目难度不大,明确化学反应与能力变化的关系为解答关键,注意掌握原电池工作原理,试题培养了学生的灵活应用能力.


科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 离子化合物中,一个阴离子可同时与多个阳离子之间有静电作用 | |
| B. | 离子化合物中的阳离子都是金属离子 | |
| C. | 溶于水可以导电的化合物一定是离子化合物 | |
| D. | 凡是金属元素跟非金属元素化合都形成离子化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
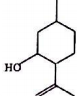
| A. | 其分子式为C10H18O | B. | 含有1个手性碳原子 | ||
| C. | 能发生消去反应 | D. | 可与FeCl3溶液反应显示紫色 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
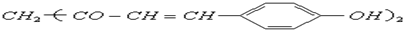 ,用它制成的试纸可以检验溶液的酸碱性.能够跟1mol该化合物起反应的Br2水溶液或H2的最大用量分别是( )
,用它制成的试纸可以检验溶液的酸碱性.能够跟1mol该化合物起反应的Br2水溶液或H2的最大用量分别是( )| A. | 3mol 3mol | B. | 3mol 5mol | C. | 6 mol 10 mol | D. | 6 mol 8 mol |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
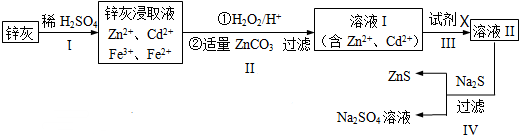
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在离子化合物里,只存在离子键,没有共价键 | |
| B. | 非极性键只存在于双原子的单质分子中 | |
| C. | 任何物质里都含有化学键 | |
| D. | 在共价化合物分子内,一定不存在离子键 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com