


 孟建平错题本系列答案
孟建平错题本系列答案 超能学典应用题题卡系列答案
超能学典应用题题卡系列答案科目:高中化学 来源: 题型:
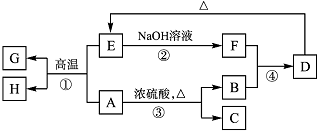 已知A、B、C、D、E、F、G、H可以发生如下图所示的转化(反应过程中部分产物已略去).其中,A、G为同一主族元素的单质,B、C、H在通常情况下为气体,化合物C是一种形成酸雨的大气污染物.
已知A、B、C、D、E、F、G、H可以发生如下图所示的转化(反应过程中部分产物已略去).其中,A、G为同一主族元素的单质,B、C、H在通常情况下为气体,化合物C是一种形成酸雨的大气污染物.查看答案和解析>>
科目:高中化学 来源: 题型:
 在密闭容器中,对于可逆反应A+3B?2C(g),平衡时物质C的体积分数与温度、压强的关系如图所示,下列判断正确的是( )
在密闭容器中,对于可逆反应A+3B?2C(g),平衡时物质C的体积分数与温度、压强的关系如图所示,下列判断正确的是( )| A、A一定为气体,B一定为固体或液体 |
| B、B一定为气体,A一定为固体或液体 |
| C、若正反应的△H<0,则T1<T2 |
| D、若正反应的△H<0,则T1>T2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Al3+、Na+、NO3ˉ、Clˉ |
| B、K+、Na+、Clˉ、NO3ˉ |
| C、K+、Na+、Clˉ、AlO2ˉ |
| D、K+、NH4+、SO32ˉ、NO3ˉ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、在周期表中,氯元素位于硫元素之后,所以Cl2的氧化性弱于硫单质 |
| B、Cl2与硫磺的反应中,S2Cl2只是氧化产物 |
| C、在常温常压下,硫磺是原子晶体,S2Cl2是分子晶体 |
| D、S2Cl2与水反应时,既体现氧化性又体现还原性 |
查看答案和解析>>
科目:高中化学 来源: 题型:
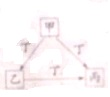
| A、若丁为KOH溶液,则甲可能为Al |
| B、若丁为Fe,则丙可能为Fe(NO3)2溶液 |
| C、若丁为O2,则甲可为非金属单质硫 |
| D、若甲、乙、丙均为焰色反应呈黄色的化合物,则丁一定为CO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、0.50mol/L |
| B、0.05mol/L |
| C、0.017mol/L |
| D、0.01mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
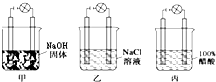 某化学兴趣小组在实验室进行化学实验,按照图甲、乙、丙连接好线路,发现甲灯泡不亮,乙灯泡亮,丙灯泡不亮.由此得出的结论正确的是( )
某化学兴趣小组在实验室进行化学实验,按照图甲、乙、丙连接好线路,发现甲灯泡不亮,乙灯泡亮,丙灯泡不亮.由此得出的结论正确的是( )| A、醋酸是非电解质 |
| B、NaOH固态时不是电解质 |
| C、NaCl溶液是电解质 |
| D、NaCl在水分子作用下电离出了可以自由移动的离子而导电 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com