
【题目】【化学选修3:物质结构与性质】
(1)原子序数小于36的元素Q和T,在周期表中既处于同一周期又位于同一族,且原子序数T比Q多2 ,Q基态原子的外围电子(价电子)排布式为____________,
T2+的未成对电子数是______________;
(2)硼砂是含结晶水的四硼酸钠,其阴离子Xm-(含B、O、H三种元素)的球棍模型如下图所示:
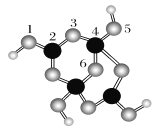
①在Xm-中,硼原子轨道的杂化类型有________;配位键存在于________原子之间(填子的数字标号);m=________(填数字)。
②硼砂晶体由Na+、Xm-和H2O构成,它们之间存在的作用力有______ (填序号)。
A.离子键 B.共价键 C.金属键 D.范德华力 E.氢键
(3)元素金(Au)处于周期表中的第六周期,与Cu同族,一种铜金合金晶体具有立方最密堆积的结构,在晶胞中Cu原子处于面心,Au原子处于顶点位置,则该合金中Cu原子与Au原子数量之比为_______;该晶体中,原子之间的作用力是__________;上述晶体具有储氢功能,氢原子可进入到由Cu原子与Au原子构成的四面体空隙中。若将Cu原子与Au原子等同看待,该晶体储氢后的晶胞结构与CaF2结构相似,该晶体储 氢后的化学式应为__________ 。
【答案】 3d64s2 2 sp2、sp3 4,5(或5,4) 2 ADE 3:1 金属键 H8AuCu3
【解析】(1)原子序数小于36的元素Q和T,在周期表中既处于同一周期又位于同一族,则Q、T都属于第Ⅷ族元素,原子序数T比Q多2,可以确定Q为Fe元素, T为Ni元素;Fe元素是26号元素,Fe原子价态排布式为3d64s2; Ni2+的核外电子排布式为1s22s22p63s23d8,3d能级有2个单电子,即未成对电子数为2。
故答案为:3d64s2;2;
(2)①1,3,5,6代表氧原子;2,4代表B原子;2号B形成3个键,则B原子为sp2杂化,4号B形成4个键,则B原子为sp3杂化;B一般形成3个键,4号B形成4个键,其中1个键很可能就是配位键,配位键存在于4号与5号之间。②观察模型,可知Xm-是(H4B4O9) m-,依据化合价H为+1,B为+3,O为-2,可得m=2。
故答案为:sp2、sp3;4,5(或5,4);2;
②Na+与Xm-形成离子键,结晶水分子之间存在氢键和范德华力,故答案为:ADE;
(3)元素金(Au)处于周期表的第六周期,与Cu同族,则最外层电子数为1,价电子排布式为5d106s1;在晶胞中Cu原子处于面心,N(Cu)=6×![]() =3,Au原子处于顶点位置,N(Au) =8×
=3,Au原子处于顶点位置,N(Au) =8×![]() =1,则该合金中Cu原子与Au原子数量之比为3∶1。该晶体为金属晶体,原子间的作用力为金属键;CaF2的结构如图
=1,则该合金中Cu原子与Au原子数量之比为3∶1。该晶体为金属晶体,原子间的作用力为金属键;CaF2的结构如图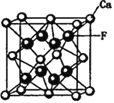 ,将Cu原子与Au原子等同看待,该晶体储氢后的晶胞结构与CaF2的结构相似,Cu原子处于面心,所以晶胞中Cu原子个数为3,Au原子处于顶点位置,所以晶胞中由Au原子个数为1,氢原子可进入到由Cu原子与Au原子构成的四面体空隙中,则H原子应位于晶胞内部,含8个H原子,所以化学式为H8AuCu3。
,将Cu原子与Au原子等同看待,该晶体储氢后的晶胞结构与CaF2的结构相似,Cu原子处于面心,所以晶胞中Cu原子个数为3,Au原子处于顶点位置,所以晶胞中由Au原子个数为1,氢原子可进入到由Cu原子与Au原子构成的四面体空隙中,则H原子应位于晶胞内部,含8个H原子,所以化学式为H8AuCu3。
故答案为:3:1;金属键;H8AuCu3。


科目:高中化学 来源: 题型:
【题目】现有三组混合物:①CCl4 和水 ②45%的酒精水溶液 ③碘水,欲分离各组混合物,采用的主要方法依次是( )
A.溶解、过滤 、结晶B.分液、蒸馏、萃取
C.萃取、分液、蒸馏D.蒸馏、分液、萃取
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知3.6 g碳在6.4 g氧气中燃烧,至反应物耗尽,测得放出热量a kJ。又知12.0 g碳完全燃烧,放出热量为 b kJ。则热化学方程式C(s)+![]() O2(g)===CO(g) ΔH=Q 中Q等于( )
O2(g)===CO(g) ΔH=Q 中Q等于( )
A. -(a-b) kJ·mol-1 B. -(a+b) kJ·mol-1
C. -(5a-0.5b) kJ·mol-1 D. -(10a-b) kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有关如图所示原电池的叙述,正确的是(盐桥中装有含琼胶的KCl饱和溶液)( )
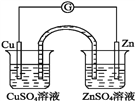
A. 铜片上发生氧化反应 B. 取出盐桥后,电流计依然发生偏转
C. 反应中,盐桥中的K+会移向CuSO4溶液 D. 反应前后铜片质量不改变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在生产和生活中应用的化学知识正确的是
A. 玻璃、水泥、水晶项链都是硅酸盐制品
B. 晶体硅是在通信工程中制作光导纤维的主要原料
C. 碳酸钠在医疗上是治疗胃酸过多的一种药剂
D. 发酵粉中主要含有碳酸氢钠,能使焙制出的糕点疏松多孔
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某环保部门处理含CN-电镀废水的方法如图(CN-和CNO-中N的化合价均为-3价):
![]()
![]()
![]()
![]()
![]()
某学习小组依据上述方法,用下图实验装置进行该电镀废水处理的研究。

操作步骤:
ⅰ.先关闭装置甲的开关,再将含CN-废水与过量NaClO溶液混合,取200 mL混合液[其中c(CN-)=0.200mol/L]加入装置甲中,塞上橡皮塞。
ⅱ.待装置甲中充分反应后,打开开关,使溶液全部流入装置乙中,关闭开关。
ⅲ.测定干燥管Ⅰ增加的质量。
(1)写出装置乙中反应的离子方程式:________________________________________。
(2)装置丙中的试剂是_______________,装置丁的作用是_______________________。
(3)假定上述实验中的气体都被充分吸收。若干燥管Ⅰ增重1.408 g。则CN-被处理的百分率为__________。
(4)你认为用此装置进行实验,与(3)对比,CN-被处理的百分率将________(填“偏高”、“偏低”、“无法确定”或“无影响”),简述你的理由:________________________________。
Ⅱ.防治空气污染,燃煤脱硫很重要。目前科学家对Fe3+溶液脱硫技术的研究已取得新成果。
(5)某学习小组为了探究“SO2与Fe3+反应的产物”,将过量的SO2通入FeCl3溶液中后,各取10 mL反应液分别加入编号为A、B、C的试管中,并设计以下3种实验方案:
方案①:A中加入少量KMnO4溶液,溶液紫红色褪去。
方案②:B中加入KSCN溶液,溶液不变红,再加入新制的氯水,溶液变红。
方案③:C中加入稀盐酸酸化的BaCl2溶液,产生白色沉淀。
上述实验方案中不合理的是________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com