
工业废水中常含有一定量的Cr2O 和CrO
和CrO ,它们会对生态系统造成很大的损害,其中还原沉淀法是常用的一种处理方法。流程如下:
,它们会对生态系统造成很大的损害,其中还原沉淀法是常用的一种处理方法。流程如下:
CrO
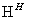 Cr2O
Cr2O
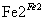 Cr3+
Cr3+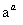 Cr(OH)3↓
Cr(OH)3↓
其中第①步中存在平衡:2CrO (黄色)+2H+
(黄色)+2H+ Cr2O
Cr2O (橙色)+H2O。下列有关说法正确的是
(橙色)+H2O。下列有关说法正确的是
A、第①步当2v(Cr2O )=v(CrO
)=v(CrO )时,达到了平衡状态
)时,达到了平衡状态
B、对于上述平衡,加入适量稀硫酸后,溶液颜色变黄色,则有利于CrO 的生成
的生成
C、常温下,Cr(OH)3的溶度积Ksp=10-32,要使c(Cr3+)降至10-5mol/L,溶液的pH应调至9
D、第②步中,还原0.1 mol Cr2O 需要91.2 g FeSO4
需要91.2 g FeSO4
【知识点】氧化还原反应 化学平衡 沉淀溶解平衡B3 G2 H5
【答案解析】D解析:没有说明v(Cr2O )、v(CrO
)、v(CrO )表示的方向,所以无法判断是否平衡,A错误;加酸后,平衡正向移动,颜色将会变成橙色,有利于Cr2O72-的生成,B错误;c(Cr3+)c3(OH-)= 10-32,c(OH-)=10-9,c(H+)=105,溶液的pH应调至5,C错误;还原0.1 mol Cr2O
)表示的方向,所以无法判断是否平衡,A错误;加酸后,平衡正向移动,颜色将会变成橙色,有利于Cr2O72-的生成,B错误;c(Cr3+)c3(OH-)= 10-32,c(OH-)=10-9,c(H+)=105,溶液的pH应调至5,C错误;还原0.1 mol Cr2O ,则FeSO4失去电子:0.1×2×(6-3)=0.6mol,需要0.6 mol FeSO4,所以需要91.2 g FeSO4,D正确。
,则FeSO4失去电子:0.1×2×(6-3)=0.6mol,需要0.6 mol FeSO4,所以需要91.2 g FeSO4,D正确。
【思路点拨】平衡状态中的v(正)=v(逆)指同种物质的正向速率与逆向速率相等。


 金牌教辅培优优选卷期末冲刺100分系列答案
金牌教辅培优优选卷期末冲刺100分系列答案科目:高中化学 来源: 题型:
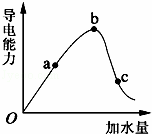
如图所示,一定温度下,冰醋酸加水稀释过程中溶液的导电能力曲线图,请回答.
(1)“O”点为什么不导电 .
(2)a、b、c三点的氢离子浓度由小到大的顺序为 .
(3)a、b、c三点中,醋酸的电离程度最大的一点是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
下列根据反应原理设计的应用,不正确的是 ( )。
A.CO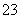 +H2OHCO
+H2OHCO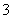 +OH- 用热的纯碱溶液清洗油污
+OH- 用热的纯碱溶液清洗油污
B.Al3++3H2OAl(OH)3+3H+ 明矾净水
C.TiCl4+(x+2)H2O(过量)TiO2·xH2O↓+4HCl制备TiO2纳米粉
D.SnCl2+H2OSn(OH)Cl↓+HCl 配制氯化亚锡溶液时加入氢氧化钠
查看答案和解析>>
科目:高中化学 来源: 题型:
氨是一种重要的化工产品,是氮肥工业、有机合成工业以及制造硝酸、铵盐和纯碱等的原料。
(1)以氨为燃料可以设计制造氨燃料电池,因产物无污染,在很多领域得到广泛应用。若电极材料均为惰性电极,KOH溶液作电解质溶液,则该电池负极电极反应式为 。
(2)在一定温度下,在固定体积的密闭容器中进行可逆反应:N2+3H2 2NH3。该可逆反应达到平衡的标志是________________。
2NH3。该可逆反应达到平衡的标志是________________。
A.3v(H2)正=2v(NH3)逆
B.单位时间生成m mol N2的同时消耗3m mol H2
C.容器内的总压强不再随时间而变化
D.混合气体的密度不再随时间变化
E.a molN≡N键断裂的同时,有6amolN—H键断裂
F.N2、H2、NH3的分子数之比为1∶3∶2
(3)某化学研究性学习小组模拟工业合成氨的反应。在容积固定为2L的密闭容器内充入1molN2和3molH2,加入合适催化剂(体积可以忽略不计)后在一定温度压强下开始反应,并用压力计监测容器内压强的变化如下:
| 反应时间/min | 0 | 5 | 10 | 15 | 20 | 25 | 30 |
| 压强/MPa | 16.80 | 14.78 | 13.86 | 13.27 | 12.85 | 12.60 | 12.60 |
则从反应开始到25min时,以N2表示的平均反应速率= ;该温度下平衡常数K= ;
(4)以CO2与NH3为原料合成尿素[化学式为CO(NH2)2]的主要反应如下,已知:
①2NH3(g)+CO2(g) == NH2CO2 NH4(s) △H= —l59.5 kJ·mol-1
②NH2CO2NH4(s)  CO(NH2)2(s)+H2O(g) △H=+116.5 kJ·mol-1
CO(NH2)2(s)+H2O(g) △H=+116.5 kJ·mol-1
③H2O(1) == H2O(g) △H=+44.0kJ·mol-1
写出CO2与NH3合成尿素和液态水的热化学反应方程式 ;
对于上述反应②在密闭容器中将过量NH2CO2NH4固体于300K下分解,平衡时P[H2O(g)]为a Pa,若反应温度不变,将体系的体积增加50%,则P[H2O(g)]的取值范围是_________________(用含a的式子表示)。(分压=总压×物质的量分数)
查看答案和解析>>
科目:高中化学 来源: 题型:
一定条件下,固定容积的密闭容器中,CO和H2反应生成甲醇: CO(g)+2H2(g) 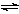 CH3OH(g)。如图是该反应在不同温度下CO的转化率随时间变化的曲线。下列判断正确的是
CH3OH(g)。如图是该反应在不同温度下CO的转化率随时间变化的曲线。下列判断正确的是
A.T1>T2
B.该反应的△H >0
C.T1时的平衡常数K1> T2时的平衡常数K2
D.T1时的平衡常数K1< T2时的平衡常数K2
查看答案和解析>>
科目:高中化学 来源: 题型:
在10L恒容密闭容器中充入X(g)和Y(g),发生反应X(g)+Y(g) M(g)+N(g)
M(g)+N(g)
所得实验数据如下表:
| 实验编号 | 温度/℃ | 起始时物质的量/mol | 平衡时物质的量/mol | |
| n(X) | n(Y) | n(M) | ||
| ① | 700 | 0.40 | 0.10 | 0.090 |
| ② | 800 | 0.10 | 0.40 | 0.080 |
| ③ | 800 | 0.20 | 0.30 | a |
| ④ | 900 | 0.10 | 0.15 | b |
回答下列问题:
(1)实验①中,若5min时测得,n(M)=0.050mo1, 则0至5min时间内,用N表示的平均反应速率为________。
(2)实验③平衡常数为___________,该正反应为____________反应(填“吸热”或“放热”)
(3)能说明上述反应一定达到平衡的条件是_______________________。
A. c(Y)= c(N) B.平均分子量不再变化
C. v正(X) =v逆(M) D.温度和压强一定时,混合气体的密度不再变化
(4)实验③中,达到平衡时,X的转化率为_________________________。
(5)实验③、④中,达到平衡时,a与b的关系为__________(填选项),请解释原因________________。
A. a>2b B. a=2b C.b<a<2b D.a<b
(6)图是实验①中c(M)随时间变化的曲线图,请在图中画出实验②中c(M)随时间变化的曲线图。

查看答案和解析>>
科目:高中化学 来源: 题型:
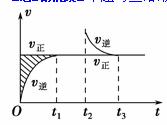
、恒温密闭容器发生可逆反应:Z(?)+W(?) X(g)+Y(?);ΔH,在t1时刻反应达到平衡,在t2时刻缩小容器体积,t3时刻再次达到平衡状态后不再改变条件。下列有关说法中正确的是 ( )
X(g)+Y(?);ΔH,在t1时刻反应达到平衡,在t2时刻缩小容器体积,t3时刻再次达到平衡状态后不再改变条件。下列有关说法中正确的是 ( )
A.Z和W在该条件下都不可能为气态
B.t1~t2时间段与t3时刻后,两时间段反应体系中
气体的平均摩尔质量不可能相等
C.若该反应只在某温度T0以上自发进行,则该反应
的平衡常数K随温度升高而增大
D.若在该温度下此反应平衡常数表达式为K=c(X),则t1~t2时间段与t3时刻后的X浓度不相等
查看答案和解析>>
科目:高中化学 来源: 题型:
用酸性氢氧燃料电池电解苦卤水(含Cl-、Br-、Na+、Mg2+)的装置如下图所示(a、b为石墨电极).下列说法中,正确的是 ( )

A.电池工作时,正极反应式为:O2+2H2O+4e-===4OH-
B.电解时,a电极周围首先放电的是Br-而不是Cl-,说明当其他条件相同时前者的还原性强于后者
C.电解时,电子流动路径是:负极→外电路→阴极→溶液→阳极→正极
D.忽略能量损耗,当电池中消耗0.02 g H2时,b极周围会产生0.04 g H2
查看答案和解析>>
科目:高中化学 来源: 题型:
在给定的四种溶液中加入以下各种离子,各离子能在原溶液中共存的是( )
|
| A. | 滴加石蕊试液显红色的溶液:Fe3+、NH4+、Cl﹣、SCN﹣ |
|
| B. | pH为1的溶液:Cu2+、Na+、Mg2+、NO3﹣ |
|
| C. | 水电离出来的c(H+)=10﹣13mol/L的溶液:K+、HCO3﹣、Br﹣、Ba2+ |
|
| D. | 所含溶质为Na2SO4的溶液:K+、CO32﹣、NO3﹣、Al3+ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com