
| A、若X和Y处于同一周期,则X的原子半径肯定小于Y的原子半径 |
| B、若X和Y处于不同的周期,则M溶于水所得溶液肯定呈碱性 |
| C、若M属于共价化合物,则该分子中原子个数比可能为1:2 |
| D、若M属于离子化合物,则该化合物中只存在离子键 |


科目:高中化学 来源: 题型:
| A、常温下,pH=3的盐酸与pH=11的氨水溶液中水的电离程度相同 |
| B、滴定相同体积和物质的量浓度的盐酸和醋酸,消耗一定物质的量浓度的烧碱溶液的体积相同 |
| C、0.1 mol/L的Na2CO3溶液和0.01 mol/LNaHCO3溶液中离子种类相同,而且都满足关系式:c(Na+)=c(HCO3-)+2c(CO32-)+c(OH-)-c(H+) |
| D、常温下,pH值之和为14的醋酸和NaOH溶液,等体积混合后,溶液pH>7 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、利用NaOH溶液除去金属铝表面的氧化膜的 |
| B、NaCl溶液与CH3COONH4溶液均呈中性,说明两溶液中水的电离程度相同 |
| C、1mol某醇与足量的钠反应生成22.4L氢气(标况下),该醇为二元醇 |
| D、向KI溶液中滴加氯水和CCl4,振荡,静置后溶液出现分层且下层显紫色,证明Cl2氧化性强于I2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、常温常压下,8gO2含有4NA个电子 |
| B、1L 1mol/L 的NaClO 溶液中含有ClO-的数目为NA |
| C、标准状况下,22.4L盐酸含有NA个HCl分子 |
| D、1mol Na被完全氧化生成Na2O2,失去2NA个电子 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、稀盐酸滴在石灰石上:CaCO3+2H+═Ca2++H2CO3 |
| B、硝酸银溶液与食盐水的反应:Ag++Cl-═AgCl↓ |
| C、锌与盐酸的反应:Zn+2H++2Cl-═Zn2++2Cl-+H2↑ |
| D、氧化铜与稀硫酸的反应:CuO+2H++SO42-═CuSO4+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:

- 2 |
- 3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
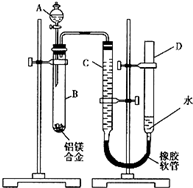 含镁3%-5%的镁铝合金,现已成为轮船制造、化工生产、机械制造等行业的重要原材料.现有一块已知质量为m1g的镁铝合金,欲测定其中镁的质量分数,几位同学设计了以下三种不同的实验方案:
含镁3%-5%的镁铝合金,现已成为轮船制造、化工生产、机械制造等行业的重要原材料.现有一块已知质量为m1g的镁铝合金,欲测定其中镁的质量分数,几位同学设计了以下三种不同的实验方案:| 足量的NaOH溶液 |
| 足量盐酸 |
| () |
| () |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com