
【题目】氢能作为高效清洁的二次能源,应用前景日益广泛。二甲醚制氢技术是实现小规模现场制氢的一种理想方案。其反应原理主要分两步:
二甲醚水解:CH3OCH3(g)+H2O(g) ![]() 2CH3OH(g) ΔH1=+23.53kJ/mol 反应Ⅰ
2CH3OH(g) ΔH1=+23.53kJ/mol 反应Ⅰ
甲醇与水蒸汽重整:CH3OH(g)+H2O(g) ![]() 3H2(g)+CO2(g) ΔH2=+49.48kJ/mol 反应Ⅱ
3H2(g)+CO2(g) ΔH2=+49.48kJ/mol 反应Ⅱ
回答下列问题。
(1)反应CH3OCH3(g)+3H2O(g) ![]() 6H2(g)+2CO2(g) ΔH3=_________。该反应自发进行的条件是___________(填“高温”、“低温”或“任意条件”)。
6H2(g)+2CO2(g) ΔH3=_________。该反应自发进行的条件是___________(填“高温”、“低温”或“任意条件”)。
(2)实验室条件下,二甲醚与水蒸汽以物质的量之比1:3混合,以固定的高流速通过填充有催化剂HZSM-5(分子筛)反应器。测得如下关系图(图1和图2)。图2中的平衡值是指不同温度下的平衡转化率。
已知:二甲醛转化率=![]()
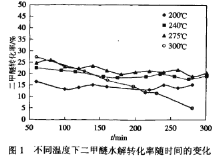
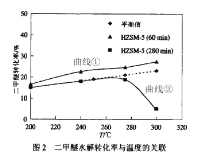
①下列说法合理的是__________
A.图1中表明,催化剂HZSM-5的活性只受温度影响,与反应持续时间无关
B.图1中使用不同的催化剂可以改变二甲醚水解的平衡转化率
C.图2中曲线①数值高于平衡值,是因为催化剂可能会吸附部分未反应的二甲醚
D.图2中曲线①和曲线②在275℃前二甲醚的转化率与平衡转化率的趋势一致,这与反应I和反应II是吸热反应有关
E.图2中曲线②在在较低温度时二甲醚的转化率与平衡值保持一致,主要是反应持续280min后已达到平衡状态
②图2曲线②数值在280℃之后明显下降,解释可能原因___________
(3)在固定体积容器内,二甲醚与水蒸汽以物质的量之比1:3投料,温度恒定为150℃,二甲醚的平衡转化率约为15%,平衡时容器内总压为P0,升温到280℃并保持恒定,再次达到平衡,此时二甲醚平衡转化率接近22%,而容器内总压约为1.5P0,请解释升温二甲醚平衡转化率增大的原因。__________________
(4)研究表明,在相同条件下,反应Ⅰ的活化能远小于反应Ⅱ的活化能,在固定体积容器内,二甲醚与水蒸汽以物质的量之比1:3投料,温度恒定为250℃,反应在t1时刻达到平衡,在图中作出甲醇含量随时间变化的关系图____________________。
【答案】+122.49kJ/mol 高温 CDE 催化剂失活(失效),或答催化剂寿命降低 各反应的正方向均为吸热且气体分子数增多,升温使平衡正向移动的效应大于压强增大使平衡逆向移动的效应 作图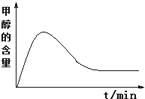
【解析】
判断一个反应能否自发进行,依据是![]() ,当
,当![]() <0时,该反应可以自发进行。催化剂对于反应的平衡转化率无影响,加入催化剂的目的一方面是提高反应速率,在相同的时间内,尽可能的获取更高的转化率,另一方面催化剂对于提高产物选择性也有很大帮助;催化剂在使用时,存在最适操作条件,温度过低催化剂活性较低,温度过高则会有使催化剂烧结失活的风险;催化剂在长时间使用后,由于表面积碳或吸附其他物质等原因,催化活性也会有所降低。反应活化能越大,对反应速率越不利,因此二甲醚现场制氢的反应中,第一步转化为甲醇的反应进行较快,而第二步甲醇转化为氢气的反应进行较慢,这样会在短时间内造成甲醇的积累,随着时间推移,上述反应各自达到平衡,甲醇的浓度最终还会下降。
<0时,该反应可以自发进行。催化剂对于反应的平衡转化率无影响,加入催化剂的目的一方面是提高反应速率,在相同的时间内,尽可能的获取更高的转化率,另一方面催化剂对于提高产物选择性也有很大帮助;催化剂在使用时,存在最适操作条件,温度过低催化剂活性较低,温度过高则会有使催化剂烧结失活的风险;催化剂在长时间使用后,由于表面积碳或吸附其他物质等原因,催化活性也会有所降低。反应活化能越大,对反应速率越不利,因此二甲醚现场制氢的反应中,第一步转化为甲醇的反应进行较快,而第二步甲醇转化为氢气的反应进行较慢,这样会在短时间内造成甲醇的积累,随着时间推移,上述反应各自达到平衡,甲醇的浓度最终还会下降。
(1)由题可知,![]() ;根据公式
;根据公式![]() ,该反应
,该反应![]() ,并且
,并且![]() ,所以在较高温度下,会出现
,所以在较高温度下,会出现![]() 的情况,因此,该反应在高温下会自发进行;
的情况,因此,该反应在高温下会自发进行;
(2)①A.观察图1,在不同温度下,随着时间推移,转化率几乎都呈现下降的趋势,所以反应持续时间也会影响转化率,A项错误;
B.催化剂不会改变反应的平衡转化率,B项错误;
C.催化剂比表面积很大,因此,催化剂表面可能吸附了二甲醚导致测得的转化率高于平衡转化率,C项正确;
D.反应Ⅰ和反应Ⅱ都是吸热反应,随着温度升高,平衡转化率也会逐渐增大,D项正确;
E.随着反应持续时间增加,获得的转化率会与平衡转化率越来越接近,E项正确;
答案选CDE;
②催化剂在使用时,有最适操作条件,温度过高可能会使催化剂失活,进而导致催化效率明显下降;
(3)反应Ⅰ和反应Ⅱ都是吸热反应,此外这两个反应正向进行又都会使气相物质总量增加,即升温对于反应正向进行有利,压强增大对于反应正向进行不利;对于同一份气体,根据公式![]() 可知,升温会使压强增大;考虑到该反应在升温后转化率仍然是增大的,这就说明温度改变对平衡的影响比压强改变对平衡的影响更明显;
可知,升温会使压强增大;考虑到该反应在升温后转化率仍然是增大的,这就说明温度改变对平衡的影响比压强改变对平衡的影响更明显;
(4) 反应Ⅰ的活化能比反应Ⅱ低,所以第一步转化为甲醇的反应进行较快,而第二步甲醇转化为氢气的反应进行较慢,这样会在短时间内造成甲醇的积累,随着时间推移,上述反应各自达到平衡,甲醇的浓度最终还会下降;因此图像中甲醇的浓度先上升,后下降,最后几乎不变。


 阳光考场单元测试卷系列答案
阳光考场单元测试卷系列答案 名校联盟冲刺卷系列答案
名校联盟冲刺卷系列答案 名校提分一卷通系列答案
名校提分一卷通系列答案 课程达标测试卷闯关100分系列答案
课程达标测试卷闯关100分系列答案科目:高中化学 来源: 题型:
【题目】如图为实验室制取乙酸乙酯的装置。请回答:
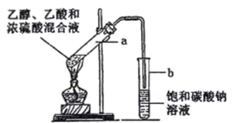
(1) 写出乙酸、乙醇酯化反应方程式__________
(2) 浓硫酸的作用是__________
(3) 下列有关该实验的说法中,正确的是__________
A.向 a 试管中加入沸石,其作用是防止加热时液体暴沸
B.饱和碳酸钠溶液可以除去产物中混有的乙酸
C.乙酸乙酯是一种无色透明、密度比水大的油状液体
D.若原料为 CH3COOH 和 CH3CH218OH,则乙酸乙酯中不含18O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】元素周期表是学习化学的重要工具,它隐含着许多信息和规律。如图是元素周期表的一部分,表中所列序号①、②、③、④、⑤、⑥、⑦、⑧分别代表某种化学元素。根据表格所给信息,回答下列问题:
族 周期 | ⅠA | 0 | ||||||
1 | ① | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | |
2 | ② | ③ | ||||||
3 | ⑤ | ⑥ | ⑦ | ④ | ⑧ | |||
(1)8种元素中,性质最稳定的是___(填元素符号)。
(2)①与④可形成___化合物(填“共价”、“离子”),其电子式为___。
(3)原子半径②___③,①___⑤(填“>”、“<”或“=”)。
(4)在元素⑤、⑥、⑦中,金属性最强的元素是___。(填元素符号)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】羟胺的电离方程式为: NH2OH+H2O ![]() NH3OH++OH-( 25℃时, Kb=9.0×l0-9)。用 0.l mol·L-1 盐酸滴定 20 mL 0.l mol·L-1 羟胺溶液,恒定 25℃时,滴定过程中由水电离出来的 H+浓度的负对数与盐酸体积的关系如图所示(己知: lg3=0.5)。下列说法正确的是
NH3OH++OH-( 25℃时, Kb=9.0×l0-9)。用 0.l mol·L-1 盐酸滴定 20 mL 0.l mol·L-1 羟胺溶液,恒定 25℃时,滴定过程中由水电离出来的 H+浓度的负对数与盐酸体积的关系如图所示(己知: lg3=0.5)。下列说法正确的是
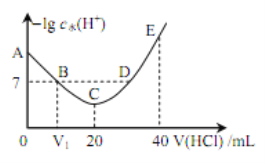
A. 图中 V1>10
B. A 点对应溶液的 pH=9.5
C. B、 D 两点对应的溶液均为中性
D. E 点对应溶液中存在:c(H+)=c (OH-)+c (NH3OH+)+c (NH2OH)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究小组利用右图所示装置制备CO2气体,其中K为止水夹,多孔塑料板固定在试管的某一位置。请问答以下问题:
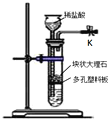
(1)当止水夹K打开时,大理石即可与稀盐酸反应产生CO2气体;当止水夹关闭后,该反应可随后停止。起到这种随关随停作用的主要原因是 __________
(2)实验室可以利用上述装置制备某些气体,能达到随开随用,随关随停的有__________
A.锌粒和稀硫酸制氢气 B.浓盐酸和二氧化锰制取氯气
C.Na2SO3固体和硫酸反应制备SO2 D.利用FeS块状固体与稀硫酸反应制备H2S气体
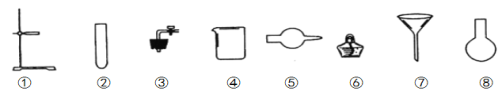
(3)请你选用如图所示的部分仪器,装配成一个简易的、能随开随用、随关随停的CO2气体发生装置。应选用的仪器是__________(填仪器的编号)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】苯氧乙醇在化妆品、护肤品、疫苗及药品中发挥着防腐剂的功用,其结构为![]() ,下列有关说法不正确的是
,下列有关说法不正确的是
A.苯氧乙醇的分子式为C8H10O2
B.苯氧乙醇中的所有碳原子不可能处于同一平面内
C.苯氧乙醇既可以发生取代反应和加成反应,也可以使酸性高锰酸钾溶液褪色
D.分子式为C8H8O2,结构中含有苯环且能与饱和NaHCO3溶液反应的物质共有4种(不考虑立体异构)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯碱工业以电解精制饱和食盐水的方法制取氯气、氢气、烧碱,以及生产ClO2 和氯的含氧酸盐(NaClO、NaClO3)等系列化工产品。
(1)写出氯碱工业中电解饱和食盐水的离子方程式:________。
(2)①室温下,0.1 mol·L–1 NaClO溶液的pH___ 0.1 mol·L–1 Na2SO3溶液的pH。(填“大于”、“小于”或“等于”)已知:H2SO3的Ka1=1.54×10–2,Ka2=1.02×10–7;HClO的Ka=2.95×10–8
②写出一种可以证明NaHSO3溶液中HSO3–的电离程度大于HSO3–水解程度的方法:____
(3)氯气含量检测仪中,原电池工作原理示意图如图所示,则Cl2在Pt电极放电的电极反应为_____
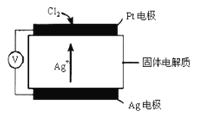
(4)工业上用NaClO3氧化酸性FeCl2废液,通过控制条件,使Fe3+水解产物聚合,形成可溶的多聚体,最终析出红棕色胶状沉淀Fe2O3·nH2O。其中水解形成羟桥配离子的离子方程式为:2Fe3++10H2O ![]() [Fe(H2O)4 (OH)2 Fe(H2O)4]4++2H+ 。欲使上述水解平衡正向移动,可采用的方法有________(填字母)。
[Fe(H2O)4 (OH)2 Fe(H2O)4]4++2H+ 。欲使上述水解平衡正向移动,可采用的方法有________(填字母)。
A.加水稀释 B.加热 C.加入盐酸 D.加入NaHCO3
(5)ClO2和Cl2均能将电镀废水中的CN– 氧化为无毒的物质,自身被还原为Cl–。处理含CN–相同量的电镀废水,所需Cl2的质量是ClO2的______ 倍。(保留三位有效数字)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮化钡(Ba3N2)是一种重要的化学试剂。高温下,向氢化钡(BaH2)中通入氮气可反应制得氮化钡。已知:Ba3N2遇水反应;BaH2在潮湿空气中能自燃,遇水反应。用图示装置制备氮化钡时,下列说法不正确的是( )
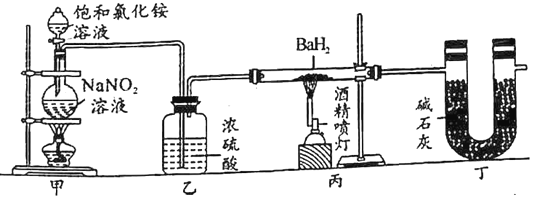
A.装置甲中反应的化学方程式为NaNO2+NH4Cl![]() N2↑+NaCl+2H2O
N2↑+NaCl+2H2O
B.BaH2遇水反应,H2O作还原剂
C.实验时,先点燃装置甲中的酒精灯,反应一段时间后,再点燃装置丙中的酒精喷灯进行反应
D.装置乙中的浓硫酸和装置丁中的碱石灰均是用于吸收水蒸气,防止水蒸气进入装置丙中
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某实验小组利用下图装置制取少量氯化铝,已知氯化铝熔沸点都很低(178℃升华),且易水解。下列说法中完全正确的一组是
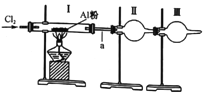
①氯气中含的水蒸气和氯化氢可通过盛有苛性钠的干燥管除去
②装置I中充满黄绿色气体后,再加热盛有A铝粉的硬质玻璃管
③装置II是收集装置,用于收集氯化铝
④装置III可盛放碱石灰也可盛放无水氯化钙,二者的作用相同
⑤a处使用较粗的导气管实验时更安全
A. ①② B. ②③⑤ C. ①④ D. ③④⑤
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com