
| 主族 周期 | IA | ⅡA | IIIA | ⅣA | ⅤA | ⅥA | ⅦA | 0族 |
| 1 | ① | |||||||
| 2 | ② | ③ | ④ | |||||
| 3 | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | |||
| 4 | ⑩ |
 .
.分析 根据元素在周期表中的位置知,①②③④⑤⑥⑦⑧⑨⑩分别是H、N、O、Ne、Na、Mg、Al、S、Cl、K元素,
(1)0族元素最外层均达到了稳定结构,故最不活泼,H为原子序数最小,半径最小的元素,S为16号元素,得到2个电子形成硫离子;
(2)元素的非金属性越强,其最高价氧化物的水化物的酸性越强;金属性越强,最高价氧化物对应水合物的碱性越强;Al的氢氧化物具有两性;
(3)元素的非金属性越强,其气态氢化物的还原性越弱;
(4)氢氧化铝与氢氧化钠反应生成偏铝酸钠和水;
(5)单质间的置换反应能确定氧化性强弱,据此解答即可.
解答 解:根据元素在周期表中的位置知,①②③④⑤⑥⑦⑧⑨⑩分别是H、N、O、Ne、Na、Mg、Al、S、Cl、K元素,
(1)Ne的最外层电子为8,达到了稳定结构,故最不活泼,名称为氖,H为原子序数最小,半径最小的元素,S为16号元素,得到2个电子形成硫离子,离子结构示意图为: ,故答案为:氖;H;
,故答案为:氖;H; ;
;
(2)元素的非金属性越强,其最高价氧化物的水化物的酸性越强,这几种元素中非金属性最强的元素是O元素,但O元素没有最高正化合价,酸性最强的化合物为HClO4,元素的金属性越强,其最高价氧化物的水化物碱性越强,金属性最强的元素是K元素,则碱性最强的化合物是KOH,具有两性的是氢氧化铝,
故答案为:HClO4;KOH;Al(OH)3;
(3)元素的非金属性越强,其气态氢化物的还原性越弱,故较强的是硫化氢,化学式为:H2S,故答案为:H2S;
(4)氢氧化铝与氢氧化钠反应生成偏铝酸钠和水,化学反应方程式为:Al(OH)3+NaOH=NaAlO2+2H2O,故答案为:Al(OH)3+NaOH=NaAlO2+2H2O;
(5)单质间的置换反应能确定氧化性强弱,即非金属性Cl>S,故氯气能置换硫化钠中的S生成单质S,故答案为:氯气与硫化钠反应生成氯化钠和硫单质.
点评 本题考查了元素周期表和元素周期律的综合应用,涉及离子结构示意图书写、化学反应方程式、元素周期律等知识点,注意O、F元素没有最高价含氧酸,为易错点.


科目:高中化学 来源: 题型:选择题
| 元素 | I1/eV | I2/eV | I3/eV |
| 甲 | 5.7 | 47.4 | 71.8 |
| 乙 | 7.7 | 15.1 | 80.3 |
| 丙 | 13.0 | 23.9 | 40.0 |
| 丁 | 15.7 | 27.6 | 40.7 |
| A. | 甲的金属性比乙强 | B. | 乙的化合价为+1价 | ||
| C. | 丙一定为金属元素 | D. | 丁一定是金属元素 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
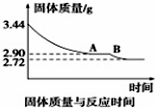 煤是重要的能源,也是生产化工产品的重要原料.试用所学知识,解答下列问题:
煤是重要的能源,也是生产化工产品的重要原料.试用所学知识,解答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 X、Y、Z、R为短周期元素且原子序数依次增大.X、R原子核外电子层数等于其最外层电子数,且原子半径X<Y,Y元素的基态原子中电子分布在3个不同的能级,且每个能级中的电子总数相同;Z 的两种同素异形体都存在于大气中,对生命起着重要作用.另有M元素位于周期表的第4周期第6列.请回答下列问题:
X、Y、Z、R为短周期元素且原子序数依次增大.X、R原子核外电子层数等于其最外层电子数,且原子半径X<Y,Y元素的基态原子中电子分布在3个不同的能级,且每个能级中的电子总数相同;Z 的两种同素异形体都存在于大气中,对生命起着重要作用.另有M元素位于周期表的第4周期第6列.请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | $\frac{W(m-n)}{m}$mol | B. | $\frac{W(m-n+2)}{m}$mol | C. | $\frac{W(m-n-2)}{m}$mol | D. | $\frac{m-n-2}{Wm}$mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 ,该环上的二溴代物有9种同分异构体,由此推断该环上的四溴代物的同分异构体数目有( )
,该环上的二溴代物有9种同分异构体,由此推断该环上的四溴代物的同分异构体数目有( )| A. | 4种 | B. | 9种 | C. | 12种 | D. | 6种 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 431 KJ/mol | B. | 946 KJ/mol | C. | 649 KJ/mol | D. | 869 KJ/mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
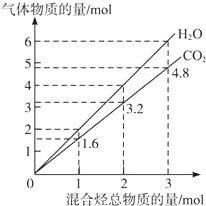 两种气态烃组成的混合气体完全燃烧后所生成CO2和H2O的物质的量随混合烃总物质的量的变化如图所示,则下列关于混合烃的判断正确的是( )
两种气态烃组成的混合气体完全燃烧后所生成CO2和H2O的物质的量随混合烃总物质的量的变化如图所示,则下列关于混合烃的判断正确的是( ) | A. | ②⑤⑥ | B. | ②⑥ | C. | ②④ | D. | ②③ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 实验 | 除杂试剂 | 实验目的 | |
| ① | 电石与水反应 | CuSO4溶液 | 用KMnO4酸性溶液检验乙炔的还原性 |
| ② | CH3CH2Br与NaOH溶液共热 | HNO3溶液 | 用AgNO3溶液检验CH3CH2Br中的Br |
| ③ | 淀粉与稀H2SO4水浴共热 | NaOH溶液 | 用新制氢氧化铜检验水解产物的还原性 |
| ④ | C2H5OH与浓H2SO4加热至170℃ | NaOH溶液 | 用Br2的CCl4溶液证明该反应为消去反应 |
| A. | 只有①②③ | B. | 只有①②④ | C. | 只有②③④ | D. | ①②③④ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com