
【化学——选修3:物质结构与性质】(15分)
A、B、C、D、E为原子序数依次增大的四种元素,A的价电子层中的未成对电子有3个,B的最外层电子数为其内层电子数的3倍,C、D为同周期元素,C元素基态原子的3p轨道上有4个电子,D元素最外层有一个未成对电子,E位于第四周期,其基态原子的内层轨道全部排满电子,且最外层电子数为2。回答下列问题:
(1)D原子的核外电子排布式为 ,E的价层电子轨道示图为_________________。
(2)单质B有两种同素异形体,其中沸点高的是 (填分子式),原因是 ;
(3)A、B、C中第一电离能最大的是________(填元素符号),其中A的氢化物(AH3)分子中,A原子轨道的杂化类型是 。
(4)化合物D2B的立体构型为 ,单质D与湿润的Na2CO3反应可制备D2B,其化学方程式为 .
(5)E与C所形成化合物晶体的晶胞如图所示。

①在1个晶胞中,E离子的数目为 。
②该化合物的化学式为 。
科目:高中化学 来源:2016届福建省高三上学期期中测试化学试卷(解析版) 题型:选择题
下列有关物质分类不正确的是
A.KNO3是钾盐、硝酸盐,也是正盐
B.铝土矿、水玻璃、碱石灰都是混合物
C.有机玻璃、氮化硅都是有机高分子材料
D.BaSO4、Na3AlF6、NH4F都是强电解质
查看答案和解析>>
科目:高中化学 来源:2016届浙江省瑞安市四校高三上学期第一次联考化学试卷(解析版) 题型:选择题
某混合溶液中可能含有下列离子中的若干种:NH4+、Na+、Al3+、Fe2+、Fe3+、AlO2-、SO42-、I-、NO3-、CO32-,已知各离子的浓度均约为0.1mol/L,现取两份20mL该溶液进行如下实验:
第一份加入足量盐酸,产生气体在空气中变为红棕色,在反应后的溶液中加入BaCl2溶液,有白色沉淀产生。第二份逐滴滴加NaOH溶液至过量,产生沉淀但不溶解,同时逸出气体。根据上述实验情况,以下说法错误的是
A.该混合溶液中一定不含有Fe3+、AlO2-、Al3+、CO32-
B.该混合溶液通过继续进行焰色反应可以间接确定是否含有I-
C.该混合溶液中肯定含有Fe2+、NH4+、SO42-、NO3-
D.向该混合溶液中滴加酚酞试液后呈红色
查看答案和解析>>
科目:高中化学 来源:2016届四川省高三上学期第一次月考化学试卷(解析版) 题型:选择题
下列有关实验说法不正确的是
A.硅酸钠溶液应保存在带橡皮塞的试剂瓶中
B.NaCl溶液蒸发结晶时,蒸发皿中有晶体析出并剩余少量液体即停止加热
C.液溴易挥发,在存放液溴的试剂瓶中应加水液封
D.沸水中滴加适量饱和FeCl3溶液,形成带电的胶体,导电能力增强
查看答案和解析>>
科目:高中化学 来源:2016届湖南省高三上学期期中测试化学试卷(解析版) 题型:填空题
(10分)化学在能源开发与利用中起着十分关键的作用。氢气是一种新型的绿色能源,又是一种重要的化工原料。
氢氧燃料电池能量转化率高,具有广阔的发展前景。现用氢氧燃料电池进行如图所示的实验(图中所用电极均为惰性电极):
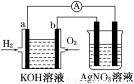
(1)对于氢氧燃料电池,下列叙述不正确的是________。
A.a电极是负极,OH-移向负极
B.b电极的电极反应为:O2+2H2O+4e-===4OH-
C.电池总反应式为:2H2+O2 2H2O
2H2O
D.电解质溶液的pH保持不变
E.氢氧燃料电池是一种不需要将还原剂和氧化剂全部储藏在电池内的新型发电装置
(2)上图右边装置中盛有AgNO3溶液,当氢氧燃料电池工作一段时间后,AgNO3溶液的pH_____________(填“增大”、“减小”或“不变”)。
(3)已知甲醇的燃烧热ΔH=-726.5 kJ/mol,在直接以甲醇为燃料的电池中,电解质溶液为酸性,负极的反应式为_______________,正极的反应式为______________。
理想状态下,该燃料电池消耗1 mol甲醇所能产生的最大电能为702.1 kJ,则该燃料电池的理论效率为__________(燃料电池的理论效率是指电池所产生的最大电能与燃料电池反应所能释放的全部能量之比)。
查看答案和解析>>
科目:高中化学 来源:2016届安徽省皖南八校高三上学期第一次联考化学试卷(解析版) 题型:填空题
硒鼓回收料含硒约97%,其余为约3%的碲和微量的氯。从该回收料中回收硒的工艺流程如下图所示(已知煅烧过程中,回收料中的硒、碲被氧化成SeO2和TeO2):

部分物质的物理性质如下表:

回答下列问题:
(1)Se与S是同族元素,比S多1个电子层,Se在元素周期表的位置为第 周期,第 族;H2 SeO4的酸性比H2SO4的酸性 (填“强”或“弱”)。
(2)实验中往往需将硒鼓回收料粉碎,其目的是
(3)乙醇浸取后过滤所得滤渣的主要成分是_____________。蒸发除去溶剂后,所得固体中仍含有少量TeO2杂质,除杂时适宜采用的方法是______________________。
(4)以SO2为还原剂可将SeO2还原为单质硒,写出反应的化学方程式:________________________
查看答案和解析>>
科目:高中化学 来源:2015-2016学年江苏省泰州市姜堰区高二上学期期中选修化学试卷(解析版) 题型:选择题
下列事实中,不能用勒夏特列原理解释的是
A.冰镇的啤酒打开后泛起泡沫
B.对N2+3H2 2NH3的反应,使用铁触媒可加快合成氨反应的速率
2NH3的反应,使用铁触媒可加快合成氨反应的速率
C.工业制取金属钾Na(l)+KCl(l)  NaCl(l)+K(g)选取适宜的温度,使K成蒸汽从反应混合物中分离出来
NaCl(l)+K(g)选取适宜的温度,使K成蒸汽从反应混合物中分离出来
D.氯水中存在如下平衡:Cl2+H2O HCl+HClO,当加入NaOH溶液后颜色变浅
HCl+HClO,当加入NaOH溶液后颜色变浅
查看答案和解析>>
科目:高中化学 来源:2015-2016学年湖北省高二上第一次月考化学试卷(解析版) 题型:选择题
已知化学方程式:2SO2(g)+O2(g)=2SO3(g) ΔH=-QkJ·mol-1(Q>0)。下列说法正确的是
A.相同条件下,2 mol SO2 (g)和1mol O2(g)所具有的总能量低于2molSO3(g)所具有的能量
B.将2 mol SO2 (g)和1 mol O2(g)置于一密闭容器中充分反应后,放出热量为Q kJ
C.增大压强或升高温度,该平衡都向逆反应方向移动
D.如将一定量SO2(g)和O2(g)置于某密闭容器中充分反应后放热Q kJ,则此过程中有2mol SO2(g)被氧化
查看答案和解析>>
科目:高中化学 来源:2015-2016学年安徽省高一上学期第一次月考化学试卷(解析版) 题型:选择题
1.6克某气体在标准状况下的体积为1.12L,则其相对分子质量为
A.16 B.28 C.32 D.48
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com