
⑴反应Fe(s)+CO2(g) FeO(s)+CO(g) △H1,平衡常数为K1;反应Fe(s)+H2O(g)
FeO(s)+CO(g) △H1,平衡常数为K1;反应Fe(s)+H2O(g) FeO(s)+H2(g) △H2,平衡常数为K2;在不同温度时K1、K2的值如下表:
FeO(s)+H2(g) △H2,平衡常数为K2;在不同温度时K1、K2的值如下表:
700℃ | 900℃ | |
K1 | 1.47 | 2.15 |
K2 | 2.38 | 1.67 |
①反应CO2(g)+H2(g) CO(g)+H2O(g) △H,平衡常数为K,则△H= (用△H1和△H2表示),K= (用K1和K2表示),且由上述计算可知,反应CO2(g) + H2(g)
CO(g)+H2O(g) △H,平衡常数为K,则△H= (用△H1和△H2表示),K= (用K1和K2表示),且由上述计算可知,反应CO2(g) + H2(g) CO(g) + H2O(g)是 反应(填“吸热”或“放热”)。
CO(g) + H2O(g)是 反应(填“吸热”或“放热”)。
②能判断CO2(g) + H2(g) CO(g) + H2O(g)达到化学平衡状态的依据是 (填序号)。
CO(g) + H2O(g)达到化学平衡状态的依据是 (填序号)。
A.容器中压强不变 B.混合气体中c(CO)不变
C.v正(H2)= v逆(H2O) D.c(CO)= c(CO2)
⑵一定温度下,向某密闭容器中加入足量铁粉并充入一定量的CO2气体,发生反应Fe(s)+CO2(g) FeO(s)+CO(g) △H > 0,CO2的浓度与时间的关系如图所示。
FeO(s)+CO(g) △H > 0,CO2的浓度与时间的关系如图所示。
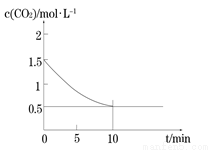
① 该条件下反应的平衡常数为 ;若铁粉足量,CO2的起始浓度为2.0 mol·L-1,则平衡时CO2的浓度为_________mol·L-1。
②下列措施中能使平衡时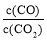 增大的是_________(填序号)。
增大的是_________(填序号)。
A.升高温度 B.增大压强 C.充入一定量的CO2 D.再加入一定量铁粉
科目:高中化学 来源: 题型:多选题
| A. | NaCl(固)+HNO3(浓)$\frac{\underline{\;\;△\;\;}}{\;}$NaNO3+HCl↑ | |
| B. | NaBr(固)+H3PO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$NaH2PO4+HBr↑ | |
| C. | H2+I2$\frac{\underline{\;\;△\;\;}}{\;}$2HI | |
| D. | CaF2+H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CaSO4+2HF↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | SO2有漂白性,因而SO2可使溴水褪色 | |
| B. | Cl2有漂白性,因而Cl2能使品红溶液褪色 | |
| C. | 浓硫酸有吸水性,因而浓硫酸可用于干燥H2和CO | |
| D. | Fe3+有强氧化性,因而FeCl3溶液可用于回收废旧电路板中的铜 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NH4+、Al3+、SO42-、NO3- | B. | K+、Ba2+、NO3-、CO32- | ||
| C. | K+、MnO4-、NH4+、NO3- | D. | Na+、K+、HCO3-、NO3- |
查看答案和解析>>
科目:高中化学 来源:2016-2017学年山东省德州市高二上10月月考化学试卷(解析版) 题型:选择题
无水氯化铝是一种重要的催化剂,工业上由Al2O3制备无水氯化铝的反应为2Al2O3(s)+6Cl2(g)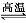 4AlCl3(g)+3O2(g) ΔH>0。下列分析错误的是( )
4AlCl3(g)+3O2(g) ΔH>0。下列分析错误的是( )
A.增大反应体系的压强,反应速率增大
B.加入碳粉,平衡向右移动,原因是碳与O2反应,降低了生成物的浓度且放出热量
C.电解熔融的Al2O3和AlCl3均能得到单质铝
D.升高温度,反应的平衡常数将增大
查看答案和解析>>
科目:高中化学 来源:2016-2017学年山东省德州市高二上10月月考化学试卷(解析版) 题型:选择题
1mol白磷转化为红磷时放出18.39kJ热量,已知:P4(白磷,s)+5O2(g)=2P2O5(s) ΔH=-a kJ/mol(a>0);4P(红磷,s)+5O2(g)=2P2O5(s) ΔH=-bkJ/mol(b>0),则a和b的关系是( )
A.a > b B. a = b C.a < b D.无法确定
查看答案和解析>>
科目:高中化学 来源:2016-2017学年江苏省徐州市高一上第一次月考化学卷(解析版) 题型:选择题
用NA表示阿伏加德罗常数的值,下列说法正确的是
A.11.2 L H2中含有氢原子的个数为NA
B.在标准状况下,22.4 L H2O中含有氢原子的个数为2NA
C.32 g O3中含有氧原子的个数为2NA
D.1 mol/L NaCl溶液中含有钠离子的个数为NA
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
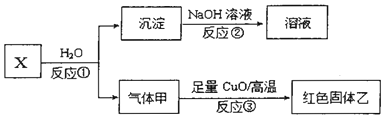
 写出反应①的化学方程式Al4C3+12H2O=4Al(OH)3+3CH4.
写出反应①的化学方程式Al4C3+12H2O=4Al(OH)3+3CH4.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com