
 25℃时,将一定量的冰醋酸(即无水乙酸)加水稀释,稀释过程中溶液的导电性变化如图所示.则下列说法错误的是( )
25℃时,将一定量的冰醋酸(即无水乙酸)加水稀释,稀释过程中溶液的导电性变化如图所示.则下列说法错误的是( )| A. | 醋酸的电离度:a<b<c | |
| B. | 溶液中c(H+):b>a>c | |
| C. | a、b、c三点的溶液都有c(H+)=c(CH3COO-)+c(OH-) | |
| D. | 从b点到c点,溶液中$\frac{c(C{H}_{3}CO{O}^{-})}{c(C{H}_{3}COOH)}$的比值减小 |
分析 醋酸为弱电解,浓度越小,电离程度越大,对于该溶液,电离程度反应了氢离子的浓度,溶液导电能力越大,离子浓度越大,结合溶液的电荷守恒分析.
解答 解:A.醋酸为弱电解质,加水促进电离,浓度越小,电离程度越大,则乙酸的电离程度:a<b<c,故A正确;
B.电离程度反应了氢离子的浓度,溶液导电能力越大,离子浓度越大,氢离子浓度越大,pH越小,故B正确;
C.根据溶液的电荷守恒可知,a、b、c三点的溶液都有:c(H+)=c(CH3COO-)+c(OH-),故C正确;
D.从b点到c点,促进醋酸电离,溶液中醋酸根离子个数增大,醋酸分子个数减小,所以溶液中$\frac{c(C{H}_{3}CO{O}^{-})}{c(C{H}_{3}COOH)}$的比值增大,故D错误;
故选D.
点评 本题考查离子浓度大小比较、弱电解质的电离,题目难度中等,注意把握弱电解质的电离特点,明确导电能力与离子浓度大小的关系为解答关键,试题培养了学生的分析能力及灵活应用能力.


 学练快车道快乐假期暑假作业新疆人民出版社系列答案
学练快车道快乐假期暑假作业新疆人民出版社系列答案 浙大优学小学年级衔接导与练浙江大学出版社系列答案
浙大优学小学年级衔接导与练浙江大学出版社系列答案 小学暑假作业东南大学出版社系列答案
小学暑假作业东南大学出版社系列答案科目:高中化学 来源: 题型:选择题
| A. | 实验室中用铜片与稀HNO3反应制备NO2 | |
| B. | 常温下可以用铝制容器来盛装浓HNO3 | |
| C. | 实验室中用浓H2SO4干燥NH3 | |
| D. | 加热时,浓H2SO4不能将木炭氧化 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 称取在空气中久置的碳酸钠晶体143.0g | |
| B. | 定容时,仰视观察刻度线 | |
| C. | 转移溶液时,用于溶解碳酸钠晶体的烧杯没有洗涤 | |
| D. | 定容后,将容量瓶震荡摇匀,静置时发现液面低于刻度线,于是又加少量水至刻度线 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
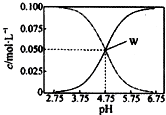 25℃时,有均满足c(CH3COO- )+c(CH3COOH)=0.10mol/L的醋酸与醋酸钠的混合溶液系列,在溶液中c(CH3COOH)、c(CH3COO- )与pH的关系如图所示.下列有关溶液中离子浓度关系的叙述中,不正确的是( )
25℃时,有均满足c(CH3COO- )+c(CH3COOH)=0.10mol/L的醋酸与醋酸钠的混合溶液系列,在溶液中c(CH3COOH)、c(CH3COO- )与pH的关系如图所示.下列有关溶液中离子浓度关系的叙述中,不正确的是( )| A. | 25℃时,醋酸的电离常数K=1.0×10-4.75 | |
| B. | W点表示的溶液中:c(CH3COO-)=c(CH3COOH)>c( Na+) | |
| C. | pH=5.5的溶液中:c(CH3COOH)>c(CH3COO- )>c(H+)>c(OH- ) | |
| D. | pH=4.0的溶液中:c( Na+)+c(H+)+c(CH3COOH)-c(OH- )=0.10mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | “天宫”一号中使用的碳纤维,是一种新型无机非金属材料 | |
| B. | 氢氧化铁溶胶、雾、食盐水均能观察到丁达尔效应 | |
| C. | 盐酸、氢氧化铁胶体、汽油、橡胶均为混合物 | |
| D. | 生成盐和水的反应不一定是中和反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题


 ,B与等物质的量Br2作用时可能有2种产物.
,B与等物质的量Br2作用时可能有2种产物. .
. .
. 等.
等.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 某同学设计了有关氯气的实验:
某同学设计了有关氯气的实验:
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 化合物都是由不同元素组成的,不同元素组成的物质一定是化合物 | |
| B. | 金属镁排在金属活动性顺序表中氢元素的前面,所以镁与酸反应一定放出氢气 | |
| C. | 中和反应都有盐和水生成,有盐和水生成的反应都属于中和反应 | |
| D. | 氧化还原反应有元素化合价变化,有元素化合价变化的反应一定是氧化还原反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com