

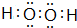 .
.分析 将D溶液滴入沸水中可得到以F为分散质的红褐色液体,说明F为Fe(OH)3,D含有铁离子,A和稀硫酸反应生成C、和S反应生成硫化物B,B和浓硫酸反应生成含有铁离子的D且D中含有硫酸根离子,所以D为Fe2(SO4)3,则A为Fe、B为FeS、C为FeSO4,硫酸亚铁和双氧水反应生成硫酸铁,硫酸铁和氨水反应生成E和F,硫酸亚铁和过氧化钠反应生成F,则E为(NH4)2SO4,H为H2SO4,结合题目分析解答.
解答 解:将D溶液滴入沸水中可得到以F为分散质的红褐色液体,说明F为Fe(OH)3,D含有铁离子,A和稀硫酸反应生成C、和S反应生成硫化物B,B和浓硫酸反应生成含有铁离子的D且D中含有硫酸根离子,所以D为Fe2(SO4)3,则A为Fe、B为FeS、C为FeSO4,硫酸亚铁和双氧水反应生成硫酸铁,硫酸铁和氨水反应生成E和F,硫酸亚铁和过氧化钠反应生成F,则E为(NH4)2SO4,H为H2SO4,
(1)红褐色液体是氢氧化铁胶体,分散质粒子直径大小的范围是1nm-100nm,
故答案为:1nm-100nm;
(2)A、B、H的化学式分别为Fe、FeS、H2SO4,故答案为:Fe;FeS;H2SO4;
(3)①H2O2分子的电子式: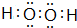 ,
,
故答案为: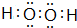 ;
;
②硫酸铁溶液与氨水气反应生成氢氧化铁与硫酸铵,反应离子方程式为Fe3++3NH3•H2O=Fe(OH)3↓+3NH4+,故答案为:Fe3++3NH3•H2O=Fe(OH)3↓+3NH4+;
(4)E中有铵根离子,可取少量E于试管中,用胶头滴管加入溶液,加热试管,可观察到试管口处湿润的红色石蕊试纸变蓝,说明有铵根离子,
故答案为:取少量E于试管中,用胶头滴管加入溶液,加热试管,可观察到试管口处湿润的红色石蕊试纸变蓝;
(5)在C(FeSO4)溶液中加入与C等物质的量的Na2O2,恰好使C转化为F(Fe(OH)3),反应的离子方程式为:4Fe2++4Na2O2+6H2O═4Fe(OH)3+O2↑+8Na+;
故答案为:4Fe2++4Na2O2+6H2O═4Fe(OH)3+O2↑+8Na+.
点评 本题考查无机物推断,为高频考点,侧重考查学生分析判断能力,明确Fe及其化合物之间的转化、离子检验方法、氧化还原反应等知识点是解本题关键,注意硫酸亚铁和过氧化钠的反应,题目难度中等.


科目:高中化学 来源: 题型:解答题
| 容器编号 | c(H2O)/mol/L | c(CO)/mol/L | c(H2)/mol/L | V正、V逆比较 |
| Ⅰ | 0.06 | 0.60 | 0.10 | V正=V逆 |
| Ⅱ | 0.06 | 0.50 | 0.40 | ① |
| Ⅲ | 0.12 | 0.40 | 0.80 | V正<V逆 |
| Ⅳ | 0.12 | 0.30 | ② | V正=V逆 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 22.4LO2中所含氧气分子计量为1摩尔 | |
| B. | 1mol氧含6.02×1023个O2 | |
| C. | 摩尔是国际科学界建议采用的一种物理量 | |
| D. | 摩尔是物质的量的单位,简称摩,符号为mol |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| 物质类别 | 酸 | 碱 | 盐 | 金属氧化物 | 非金属氧化物 |
| 化学式 | ①HCl ②H2SO4、H2CO3、H2SO3、H2S | ③NaOH、KOH ④Ba(OH)2 | ⑤Na2SO4 ⑥Na2CO3、Na2SO4、Na2SO3、Na2S | ⑦Na2O | ⑧CO2 ⑨H2O2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com