
【题目】化学让生活更美好。他一直在践行,如消除饮用水中的有毒物质,保证人民的生活质量。
(1)饮用水中的![]() 对人类健康会产生危害,为了降低饮用水中
对人类健康会产生危害,为了降低饮用水中![]() 的浓度,可以在过量NaOH溶液的条件下用铝粉将
的浓度,可以在过量NaOH溶液的条件下用铝粉将![]() 还原为N2,写出其其离子方程式为:______________________________________________。
还原为N2,写出其其离子方程式为:______________________________________________。
上述反应中,_________元素的化合价升高,则该元素的原子_______(填“得到”或“失去”)电子。当有1mol N2生成时,反应中转移电子的数目为____________。
(2)洪灾过后,饮用水的消毒杀菌成为抑制大规模传染性疾病爆发的有效方法之一。漂白粉是常用的消毒剂。工业上将氯气通入石灰乳[Ca(OH)2]制取漂白粉,化学方程式为__________________________________________________。(已知,氯气在石灰乳中发生歧化反应,其中一种产物是Ca(ClO)2)
(3)KA1(SO4)212H2O的俗名为_________,因其溶于水生成_____________(化学式)可以吸附杂质,从而达到净水作用。
【答案】10Al+6NO3-+4OH-=10AlO2-+3N2↑+2H2O Al 失去 6.02×1024 2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O 明矾 Al(OH)3
【解析】
本题是一个常见的信息给予题,只要根据学过的铝、氯气、胶体的知识来解答即可。
(1)铝在碱性条件下的氧化产物为![]() ,该过程失去3个电子,
,该过程失去3个电子,![]() 被还原成0价的
被还原成0价的![]() ,该过程得到5个电子,因此氧化剂和还原剂的计量数之比为3:5,结合原子守恒和电荷守恒,反应的离子方程式为:
,该过程得到5个电子,因此氧化剂和还原剂的计量数之比为3:5,结合原子守恒和电荷守恒,反应的离子方程式为:![]() ;该过程中铝元素的化合价升高,失去电子。根据化学计量数之比可知:当生成3mol
;该过程中铝元素的化合价升高,失去电子。根据化学计量数之比可知:当生成3mol![]() 时,反应一共转移了30mol电子,则当生成1mol
时,反应一共转移了30mol电子,则当生成1mol![]() 时,反应中转移的电子数为10NA;
时,反应中转移的电子数为10NA;
(2)题目告诉我们氯气在石灰乳中发生了歧化反应,Cl元素的化合价一部分升高为+1价,另一部分降低到-1价,即生成![]() ,据此写出化学方程式为:
,据此写出化学方程式为:![]() ;
;
(3)十二水合硫酸铝钾即我们常说的明矾,它净水的原理是因为铝离子在水中可以水解产生氢氧化铝胶体,胶体具有吸附性,从而达到净水的作用。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】铁能形成多种化合物,如Fe(SCN)3,[Fe(CO)5](羰基铁),它们在生活生产中有广泛应用。
(1)Fe3+基态核外电子排布式为_____。
(2)实验室用KSCN溶液、苯酚溶液检验Fe3+.N、O、S的第一电离能由大到小的顺序为____ 。SCN﹣中的碳原子的杂化轨道类型为_____。与SCN﹣互为等电子体的分子是_____。
(3)羰基铁[Fe(CO)5]可用作催化剂。1mol[Fe(CO)5]分子中含σ键数目为_____。
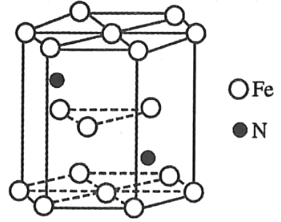
(4)某种氮化铁晶胞的晶体如图所示,该氮化铁晶体的化学式为_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
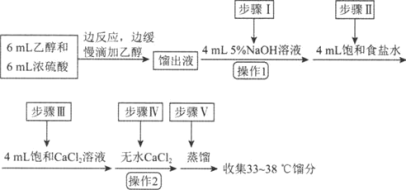
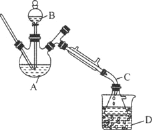
【题目】乙醚是有机合成中常用的溶剂。某实验小组在实验室利用乙醇脱水制备乙醚,装置示意图(夹持和加热装置已略去)、有关数据和实验步骤如下:
物质 | 相对分子质量 | 密度/(g·mL-1) | 沸点/℃ | 在水中的溶解性 |
乙醇 | 46 | 0.816 | 78 | 互溶 |
乙醚 | 74 | 0.713 | 34.6 | 不溶 |
已知:①相同条件下,乙醚在饱和食盐水中比在水中更难溶。
②氯化钙可与乙醇形成络合物CaCl2·6C2H5OH。
请回答下列问题:
(1)仪器B的名称为________。
(2)由乙醇制备乙醚的总反应为2C2H5OH![]() CH3CH2OCH2CH3+H2O,此反应分两步进行,第一步反应的化学方程式为:CH3CH2OH+H2SO4
CH3CH2OCH2CH3+H2O,此反应分两步进行,第一步反应的化学方程式为:CH3CH2OH+H2SO4![]() CH3CH2OSO2OH+H2O,则第二步反应的化学方程式为________。
CH3CH2OSO2OH+H2O,则第二步反应的化学方程式为________。
(3)反应过程中,仪器B的末端应浸入反应液中,原因是________________。
(4)仪器D中盛有冰水混合物,其作用为________________。
(5)操作1的名称为________,操作2的名称为________。
(6)若省略步骤Ⅱ会导致的后果是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】热激活电池可用作火箭、导弹的工作电源。一种热激活电池的基本结构如图所示,其中作为电解质的无水LiCl-KCl混合物受热熔融后,电池即可瞬间输出电能。该电池总反应为:PbSO4+2LiCl+Ca = CaCl2+Li2SO4+Pb。下列有关说法正确的是

A. 正极反应式:Ca + 2Cl--2e- = CaCl2
B. 放电过程中,Li+向负极移动
C. 没转移0.1mol电子,理论上生成20.7 g Pb
D. 常温时,在正负极间接上电流表或检流计,指针不偏转
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】聚合硫酸铁可用于水的净化,其化学式可表示为[Fea(OH)b(SO4)c]m。取一定量聚合硫酸铁样品与足量盐酸反应,将所得溶液平均分为两份。向一份溶液中加入足量的BaCl2溶液,得到白色沉淀1.7475 g。取另一份溶液,先将Fe3+还原为Fe2+(还原剂不是Fe,且加入的还原剂恰好将Fe3+还原为Fe2+),再用0.020 00 mol/LK2Cr2O7标准溶液滴定至终点,消耗K2Cr2O7标准溶液50.00 mL。该聚合硫酸铁样品中a∶b为 ( )
A.1∶1B.2∶1C.3∶1D.2∶5
查看答案和解析>>
科目:高中化学 来源: 题型:
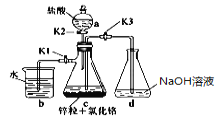
【题目】氢氧化亚铬是一种化学品,化学式Cr(OH),外观棕褐色沉淀。一般制备方法是先在封闭体系中利用金属锌作还原剂,将三价铬还原为二价铬,二价铬再与氢氧化钠溶液作用即可制得氢氧化亚铬。实验装置如图所示。回答下列问题:
已知:(1)Cr(OH)的性质和Fe(OH)相似,制备的时候要严格隔绝氧气
(2)Cr3+ 绿色,Cr2+亮蓝色
(1)实验中所用蒸馏水需要逐气,原因是_______________________,所需方法是__________。
仪器a的名称是____________。
(2)将过量锌粒和氯化铬固体置于c中,加入少量蒸馏水,按图连接好装置。打开K1、K2,关闭K3。①c中溶液由绿色惭变为亮蓝色,该反应的离子方程式为:____________________。
②同时c中有气体产生,该气体是______________ ;其作用是____________。
(3)打开K3,关闭K1、K2。c中亮蓝色溶液流入d中,其原因是______________________;
(4)指出d装置可能存在的缺点_____________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示甲是某学生验证铜和浓硝酸反应的装置,乙、丙是另外两位同学对甲装置改进后的装置:
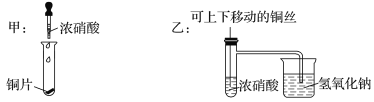
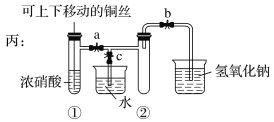
(1)甲、乙、丙三个装置中共同发生的反应的化学方程式是__________________________________。
(2)和甲装置相比,乙装置的优点是①______________________;②________________。
(3)为了进一步验证NO2和水的反应,某学生设计了丙装置。实验时先关闭活塞________,再打开活塞________,才能使NO2气体充满②试管;当气体充满②试管后,将铜丝提起与溶液脱离。欲使烧杯中的水进入②试管,应该_______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将NaOH,MgCl2,AlCl3三种固体组成的混合物溶于足量水, 产生1.16g白色沉淀, 再向所得浊液中逐渐加入1.00 mol/L的盐酸, 加入盐酸的体积与生成沉淀的关系如下图:
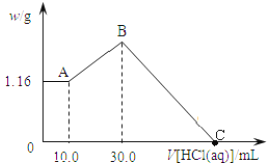
请回答:
①A点溶液中溶质有___________(填化学式);
②写出加入盐酸体积由10.0mL到30.0mL发生反应的离子方程式________________;
③原混合物中MgCl2质量是_________, AlCl3物质的量是________, NaOH质量是______。
④C点消耗盐酸的体积为___________mL。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据如图所示示意图,下列说法不正确的是
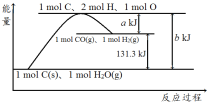
A. 反应的热化学方程式可表示为C(s)+H2O(g)![]() CO(g)+H2(g) ΔH=(b-a) kJ·mol-1
CO(g)+H2(g) ΔH=(b-a) kJ·mol-1
B. 该反应过程反应物断键吸收的能量一定大于生成物成键放出的能量
C. 使用催化剂无法改变该反应的ΔH
D. nmol C和n mol H2O反应生成nmol CO和nmol H2吸收的热量一定为131.3nkJ
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com