
【题目】利用化学原理可以对工厂排放的废水、废渣等进行有效检测与合理处理。某工厂对制革工业污泥中Cr(Ⅲ)的处理工艺流程如下:
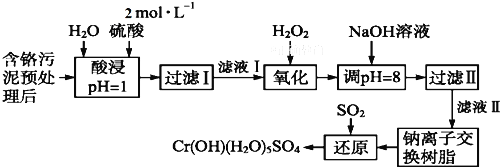
已知:①硫酸浸取液中的金属离子主要是Cr3+,其次是Fe3+、Al3+、Ca2+和Mg2+。
②常温下,部分阳离子以氢氧化物形式沉淀时溶液的pH如下:
阳离子 | Fe3+ | Mg2+ | Al3+ | Cr3+ |
沉淀完全时的pH | 3.7 | 11.1 | 5.4(>8溶解) | 9(>9溶解) |
(1)实验室用18.4 mol·L-1的浓硫酸配制480 mL 2 mol·L-1的硫酸,需量取浓硫酸_______mL;配制时所用玻璃仪器除量筒、烧杯和玻璃棒外,还需_______。
(2)H2O2的作用是将滤液Ⅰ中的Cr3+转化为Cr2O![]() ,写出此反应的离子方程式:_______。
,写出此反应的离子方程式:_______。
(3)加入NaOH溶液使溶液呈碱性,既可以除去某些杂质离子,同时又可以将Cr2O![]() 转化为______(填微粒的化学式)
转化为______(填微粒的化学式)
(4)钠离子交换树脂的反应原理为:Mn+ + n NaR = MRn + n Na+,则利用钠离子交换树脂可除去滤液Ⅱ中的金属阳离子有_____________。
(5)写出上述流程中用SO2进行还原时发生反应的离子方程式____________。
【答案】 54(54.3不给分) 500mL容量瓶、胶头滴管 2Cr3++3H2O2+H2O=Cr2O![]() +8H+ CrO
+8H+ CrO![]() Mg2+、Ca2+ 2CrO
Mg2+、Ca2+ 2CrO![]() +3SO2+12H2O=2Cr(OH)(H2O)5SO4↓+SO
+3SO2+12H2O=2Cr(OH)(H2O)5SO4↓+SO![]() +2OH-
+2OH-
【解析】
本题考查化学工艺流程的理解与分析。
由流程图可知,硫酸浸取的目的是,浸取制革工业污泥中的Cr3+、Fe3+、Al3+、Ca2+和Mg2+;加入过氧化氢氧化Cr3+离子,将Cr3+离子氧化为Cr2O72-离子;加入NaOH溶液使溶液PH=8的目的是使Fe3+、Al3+转化为氢氧化物沉淀而除去,同时又可以使Cr2O72-转化为CrO42-;钠离子交换树脂可除去滤液Ⅱ中的Ca2+和Mg2+;通入二氧化硫,二氧化硫具有还原性,被滤液Ⅱ中通过离子交换后的溶液中Na2CrO4氧化为硫酸,Na2CrO4氧被还原为CrOH(H2O)5SO4。
(1)用18.4molL-1的浓硫酸来配制480mL2molL-1的稀硫酸,应选择500mL容量瓶,实际应配制500mL溶液,设需要18.4 mol·L-1浓硫酸体积为V,依据溶液稀释过程中溶质的物质的量不变得:18.4mol/L×V=500mL×2mol/L,解得V=54mL;配制一定物质的量浓度溶液一般步骤:计算、量取、稀释、冷却、移液、洗涤、定容、摇匀、装瓶,用到的仪器有量筒、烧杯、玻璃棒、500mL容量瓶、胶头滴管,则配制时所用玻璃仪器除量筒、烧杯和玻璃棒外,还需500ml容量瓶和胶头滴管。(2)双氧水有强氧化性,能氧化还原性的物质,Cr3+有还原性,Cr3+能被双氧水氧化为高价离子,以便于与杂质离子分离,反应的离子方程式为:2Cr3++3H2O2+H2O=Cr2O72-+8H+。(3)硫酸浸取液中的金属离子主要是Cr3+,其次是Fe3+、Al3+、Ca2+和Mg2+,加入过氧化氢氧化铬离子为Cr2O72-,加入NaOH溶液使溶液呈碱性,使Cr2O72-转化为CrO42-。(4)由流程图可知,钠离子交换树脂交换的离子是钙离子和镁离子。(5)二氧化硫具有还原性,被滤液Ⅱ中通过离子交换后的溶液中Na2CrO4氧化为硫酸,Na2CrO4氧被还原为CrOH(H2O)5SO4,水溶液中生成氢氧化钠溶液和硫酸反应生成硫酸钠,反应的离子方程式为:2CrO![]() +3SO2+12H2O=2Cr(OH)(H2O)5SO4↓+SO
+3SO2+12H2O=2Cr(OH)(H2O)5SO4↓+SO![]() +2OH-。
+2OH-。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】有机物和人们生产生活密切相关
(1)某烃的密度为 3.21g/L(换算到标准状况下),充分燃烧 3.6g 该烃,生成 11g 二氧化碳和 5.4g 水。写 该烃的分子式为_______,并写出其可能存在的结构简式并用系统命名法命名____________________。
(2)某烃 A 是有机化学工业的基本原料,其产量可以用来衡量一个国家的石油化工发展水平, A 还是一种植 物生长调节剂,A 可发生如图所示的一系列化学反应,③是实验室制取 A 的反应。根据左图写出相应的化学 方程式并注明反应类型。
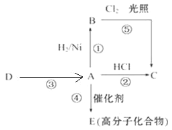
②_________________, 反应类型_________________。
③_________________, 反应类型_________________。
④_________________, 反应类型_________________。
⑤_________________, 反应类型_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在标准状况下,将aLNH3完全溶于水得到VmL氨水,溶液的密度为![]() ,溶质的质量分数为ω,溶质的物质的量浓度为C mol·L-1。则下列叙述中正确的是
,溶质的质量分数为ω,溶质的物质的量浓度为C mol·L-1。则下列叙述中正确的是
①![]() ②
②![]() ③上述溶液中再加入VmL水后,所得溶液的质量分数大于0.5ω
③上述溶液中再加入VmL水后,所得溶液的质量分数大于0.5ω
④向上述溶液中加入VmL C mol·L-1的稀盐酸,充分反应后溶液中离子浓度大小关系为:![]()
A. ②④ B. ②③ C. ①③ D. ①④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】镁—次氯酸盐燃料电池的工作原理如右图所示,该电池反应为:Mg+ClO-+H2O=Mg(OH)2+Cl-

下列有关说法正确的是( )
A.电池工作时,c溶液中的溶质一定是MgCl2
B.负极反应式:ClO--2e-+H2O=Cl-+2OH-
C.电池工作时,OH-向b电极移动
D.b电极发生还原反应,每转移0.1 mol电子,理论上生成0.1 mol Cl-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用NA表示阿伏加德罗常数的值。则下列说法中正确的是 ( )
⑴ 0.25 mol Na2O2中含有的阴离子数为0.5NA
⑵ 7.5 g SiO2晶体中含有的硅氧键数为0.5 NA
⑶ 标准状况下,2.24 L CCl4中含有的原子数为0.1 NA
⑷ 常温下,1 L 0.1 mol/L FeCl3溶液中含Fe3+数为0.1NA
⑸ 1 L 1 mol/LCH3COOH溶液中含有NA个氢离子
⑹ 常温下,2.7 g铝与足量的氢氧化钠溶液反应,失去的电子数为0.3NA
⑺ 22.4 L SO2气体,所含氧原子数为2NA
⑻ 14 g乙烯和丙烯的混合物中,含有共用电子对数目为3 NA
⑼ 25℃时,pH =13 的1.0 LBa(OH) 2 溶液中含有的OHˉ数为0.2NA
A. ⑵⑸⑻⑼ B. ⑵⑹⑻ C. ⑴⑷⑹⑻⑼ D. ⑴⑶⑸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA表示阿伏加德罗常数,下列叙述不正确的是
A. 通常状况下,1 mol SO3含有的分子数为NA
B. 1 mol OH-参与电解,转移的电子数目为NA
C. 标准状况下,含NA个氩原子的氩气体积约为22.4 L
D. 标准状况下,V L水含有的氧原子数约为VNA/22.4
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com