
【题目】某温度时,在一个5L的恒容容器中,X、Y、Z均为气体,三种物质的物质的量随时间的变化曲线如图所示。根据图中数据填空:
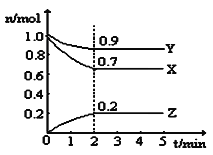
(1)该反应的化学方程式为______。
(2)反应开始至2min,以气体Z表示的平均反应速率为______。平衡时X的转化率为______。
(3)2min反应达到平衡,容器内混合气体的平均相对分子质量比起始时______![]() 填“大”、“小”或“相等”,下同
填“大”、“小”或“相等”,下同![]() ,混合气体密度比起始时______。
,混合气体密度比起始时______。
(4)下列叙述能证明该反应已经达到化学平衡状态的是![]() 填序号
填序号![]() ______。
______。
A.Y的体积分数不再变化 B.容器内气体压强不再变化
C.υ(X) :υ(Y) =3:1 D.单位时间内消耗3nmol X同时生成2nmol Z
【答案】3X(g) + Y(g) ![]() 2Z(g) 0.02 molL-1min-1 30% 大 相等 AB
2Z(g) 0.02 molL-1min-1 30% 大 相等 AB
【解析】
⑴根据图像可知,X、Y是反应物,Z为生成物,分别改变量为0.3 mol,0.1 mol,0.2 mol,根据改变量之比等于计量系数之比,因此得到该反应的化学方程式为3X(g) + Y(g) ![]() 2Z(g),故答案为:3X(g) + Y(g)
2Z(g),故答案为:3X(g) + Y(g) ![]() 2Z(g);
2Z(g);
⑵反应开始至2min,以气体Z表示的平均反应速率为![]() ,平衡时X改变量为0.3 mol,此时X的转化率为
,平衡时X改变量为0.3 mol,此时X的转化率为![]() ,故答案为0.02 molL-1min-1;30%;
,故答案为0.02 molL-1min-1;30%;
⑶2min反应达到平衡,平均相对分子质量![]() ,气体质量未变,气体物质的量减小,因此容器内混合气体的平均相对分子质量比起始时大,
,气体质量未变,气体物质的量减小,因此容器内混合气体的平均相对分子质量比起始时大,![]() ,气体质量未变,容器体积未变,混合气体密度比起始时相等,故答案为:大;相等;
,气体质量未变,容器体积未变,混合气体密度比起始时相等,故答案为:大;相等;
⑷A选项,Y的体积分数不再变化,证明达到平衡,故A正确,符合题意;
B选项,反应向右,压强不断减小,当容器内气体压强不再变化,则达到平衡,故B正确,符合题意;
C选项,υ(X) :υ(Y) = 3:1,反应速率没有正逆,因此不能说明达到平衡,故C错误,不符合题意;
D选项,单位时间内消耗3n mol X,正反应方向,同时生成2n mol Z,正反应方向,铜一个方向不能说明达到平衡,故D错误,不符合题意;
综上所述,答案为AB。


 学期复习一本通学习总动员期末加暑假延边人民出版社系列答案
学期复习一本通学习总动员期末加暑假延边人民出版社系列答案 芒果教辅暑假天地重庆出版社系列答案
芒果教辅暑假天地重庆出版社系列答案科目:高中化学 来源: 题型:
【题目】一定条件下将1 mol N2和3 mol H2置于密闭容器中发生反应N2+3H2![]() 2NH3(正反应是放热反应)。下列关于该反应的说法正确的是
2NH3(正反应是放热反应)。下列关于该反应的说法正确的是
A. 降低温度可以加快反应速率
B. 达到化学反应限度时,生成2mol NH3
C. 向容器中再加入N2可以加快反应速率
D. 1mol N2 和3mol H2的总能量低于2mol NH3的总能量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某元素的离子结构示意图为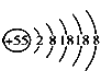 ,该离子显+1价,则该元素在周期表中的位置是( )
,该离子显+1价,则该元素在周期表中的位置是( )
A. 第5周期零族B. 第6周期第IB族
C. 第5周期第ⅦA族D. 第6周期第IA族
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述正确的是
A.Na2CO3 溶液加水稀释后,恢复至原温度,pH 和 Kw 均减小
B.0.1mol/L CH3COONa 溶液中:c(Na+)>c(CH3COO-)>c(H+)>c(OH-)
C.在 KI 溶液中加入 AgCl 固体,溶液中 c(I-)减小
D.室温下,pH=5 的 CH3COOH 溶液和 pH=5 的 NH4Cl 溶液中,溶液中 c(H+)不相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海水是巨大的资源宝库,从海水中提取食盐和溴的过程如图所示;下列描述错误的是:

A. 淡化海水的方法主要有蒸馏法、电渗析法、离子交换法
B. 以NaCl为原料可以生产烧碱、纯碱、金属钠、氯气、盐酸等化工产品
C. 步骤Ⅱ中鼓入热空气吹出溴,是因为溴蒸气的密度比空气的密度小
D. 用SO2水溶液吸收Br2的离子反应方程式为:Br2+SO2+2H2O═4H++SO42﹣+2Br﹣
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列图示与对应的叙述相符的是

图1 图2 图3 图4
A. 图1表示0.1molMgCl2·6H2O在空气中充分加热时固体质量随时间的变化
B. 图2表示用0.1000 mol·LˉlNaOH溶液滴定25.00 mLCH3COOH的滴定曲线,则c(CH3COOH)=0.0800 mol·Lˉ1
C. 图3表示恒温恒容条件下,2NO2(g)![]() N2O4(g)中,各物质的浓度与其消耗速率之间的关系,其中交点A对应的状态为化学平衡状态
N2O4(g)中,各物质的浓度与其消耗速率之间的关系,其中交点A对应的状态为化学平衡状态
D. 图4表示常温下,稀释HA、HB两种酸的稀溶液时,溶液pH随加水量的变化,则常温下,NaA溶液的pH小于同浓度的NaB溶液的pH
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,将镁片、铝片平行插入一定浓度的NaOH溶液中,用导线连成闭合回路,该装置在工作时,下列叙述中正确的是
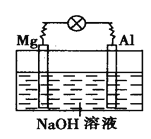
A. 镁比铝活泼,镁失去电子被氧化成Mg2+
B. 铝是电池的负极,开始工作时溶液中会立即有白色沉淀生成
C. 该装置的内、外电路中,均是电子的定向移动形成
D. 该装置开始工作时,铝片表面的氧化膜可不必处理
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,用0.10 mol/L的NaOH溶液分别滴定体积均为50.00 mL、浓度均为0.05 mol/L的HClO、HF两种溶液,其滴定曲线如图所示。
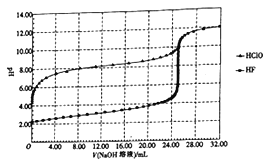
下列说法正确的是
A.HClO的酸性比HF强
B.V(NaOH)=0mL时,对应溶液中:c(ClO-)=c(F-)
C.V(NaOH)=12.50mL时,对应溶液中:c(ClO-)>c(F-)
D.V(NaOH)=25.00mL时,对应溶液中:c(ClO-)<c(F-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于2SO2(g)+O2(g)![]() 2SO3(g) △H<0的反应,下列装置示意图中的实验不能达到目的是( )
2SO3(g) △H<0的反应,下列装置示意图中的实验不能达到目的是( )
A. 研究压强对反应的影响(p2>p1)
研究压强对反应的影响(p2>p1)
B. 研究温度对反应的影响
研究温度对反应的影响
C. 研究平衡体系中增加O2浓度对反应的影响
研究平衡体系中增加O2浓度对反应的影响
D. 体积恒定的密闭容器中催化剂对反应的影响
体积恒定的密闭容器中催化剂对反应的影响
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com