
 ��
������ ��1���������ɽ������������������ӵĻ�����Ϊ�������Ԫ�ء�����һ��ΪOԪ�صĻ�����Ϊ�����
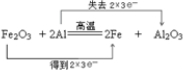
��2���ں͢��ڸ������ܷ����û���ӦΪFe2O3+3Al$\frac{\underline{\;����\;}}{\;}$Al2O3+3Fe��Alʧȥ���ӣ�Fe�õ����ӣ�ת��6e-��
��3���ٷ�ӦΪ�кͷ�Ӧ�Ҳ�����ɫ����������H2SO4+Ba��OH��2=BaSO4��+2H2O��
�ڷ�ӦΪ���ֽⷴӦ�������ݲ���������2KHCO3+H2SO4=K2SO4+2CO2��+2H2O��
��� �⣺��1���������ɽ������������������ӵĻ�����Ϊ�������Ԫ�ء�����һ��ΪOԪ�صĻ�����Ϊ����������ڼ���Тݣ�������������Тܢޣ�
�ʴ�Ϊ���ݣ��ܢޣ�
��2���ں͢��ڸ������ܷ����û���ӦΪFe2O3+3Al$\frac{\underline{\;����\;}}{\;}$Al2O3+3Fe��FeԪ�ػ��ϼ۽��ͣ�����ԭ��Fe2O3Ϊ��������AlԪ�ػ��ϼ����ߣ���������Ϊ��ԭ������Fe�õ�2��3e-��Alʧȥ2��3e-������ת����Ŀ�ͷ���ɱ�ʾΪ ���ʴ�Ϊ��
���ʴ�Ϊ�� ��
��
��3���ٷ�ӦΪ�кͷ�Ӧ�Ҳ�����ɫ����������H2SO4+Ba��OH��2=BaSO4��+2H2O�����ӷ�ӦΪ2OH-+2H++SO42-+Ba2+=BaSO4��+2H2O��
�ʴ�Ϊ��2OH-+2H++SO42-+Ba2+=BaSO4��+2H2O��
�ڷ�ӦΪ���ֽⷴӦ�������ݲ���������2KHCO3+H2SO4=K2SO4+2CO2��+2H2O�����ӷ�ӦΪH++HCO3-=CO2��+H2O��
�ʴ�Ϊ��H++HCO3-=CO2��+H2O��
���� ���⿼�����ӷ�Ӧ��������ԭ��Ӧ��Ϊ�߿��������ͣ����շ����ķ�Ӧ��Ԫ�صĻ��ϼ۱仯Ϊ���Ĺؼ���������ѧ���ķ���������Ӧ�������Ŀ��飬ע�����ӷ�Ӧ�б�����ѧʽ�����ʣ���Ŀ�ѶȲ���



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
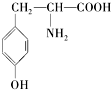 Ӫ��Ʒ��ҩƷ���DZ�֤���ཡ������ȱ�ٵ����ʣ������ʺ��Ʒ��ǻ�ѧ�о�����Ҫ���ݣ���֪�Ұ�����һ�����������ȱ�ٵİ����ᣬ���Ľṹ��ʽ�ǣ�
Ӫ��Ʒ��ҩƷ���DZ�֤���ཡ������ȱ�ٵ����ʣ������ʺ��Ʒ��ǻ�ѧ�о�����Ҫ���ݣ���֪�Ұ�����һ�����������ȱ�ٵİ����ᣬ���Ľṹ��ʽ�ǣ�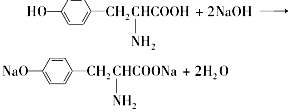 ��
���鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ��1mol CH3COONa������CH3COOH�γɵ�������Һ�У�CH3COO-��ĿΪNA�� | |
| B�� | 1mol Na��O2��ȫ��Ӧ������Na2O��Na2O2�Ļ���ת�Ƶ�������NA�� | |
| C�� | 7.8gNa2O2�����ˮ��Ӧת�Ƶ�����Ϊ0.1NA | |
| D�� | ��֪N2��g��+3H2��g��?2NH3��g����H=-92.4kJ•mol-1������3NA������ת��ʱ����H��Ϊ-46.2kJ•mol-1 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ��NaHSO4��Һ����Ba��OH��2��Һ�����ԣ�H++SO42-+Ba2++OH-�TBaSO4��+H2O | |
| B�� | ����������������Fe��OH��3+3H+�TFe3++3H2O | |
| C�� | ��������ˮ����AuCl4-���Ӻ�NO��Au+4H++4Cl-+NO3-�TAuCl4-+NO��+2H2O | |
| D�� | ��NaClO��Һ���չ�����SO2��ClO-+SO2+H2O�THSO3-+HClO |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | H2SO4��Ħ��������98 | |
| B�� | ͨ��ʱ����Һ�е����ʷ��ӷֱ��������ƶ��������еķ�ɢ��������ijһ���ƶ� | |
| C�� | �����ЧӦ������������Һ�ͽ��壬�ơ������ܲ��������ЧӦ | |
| D�� | ��98gH2SO4�ܽ���500mLˮ�У�������Һ����������ʵ���Ũ��Ϊ2mol/L |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | SO2���������������ǻ�ԭ���� | |
| B�� | CuFeS2������ԭ������Ԫ�ر����� | |
| C�� | ÿ����1mol Cu2S����4 mol������ | |
| D�� | ÿת��1.2 mol���ӣ���0.3 mol������ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ����������Һ | B�� | ����þ��Һ | C�� | ʳ��ˮ | D�� | ������Һ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ��ƶ���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
| ʵ���� | 0.01mol•L-1����KMnO4��Һ | 0.1mol•L-1H2C2O4��Һ | ˮ | 1mol•L-1MnSO4��Һ | ��Ӧ�¶�/�� | ��Ӧʱ�� |
| �� | 2mL | 2mL | 0 | 0 | 20 | 125 |
| �� | V1 mL | V2 mL | 1mL | 0 | 20 | 320 |
| �� | V3 mL | V4 mL | V5mL | 0 | 50 | 30 |
| �� | 2mL | 2mL | 0 | 2�� | 20 | 10 |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com