
| A. | ①④ | B. | ②④ | C. | ①③ | D. | ②③ |
分析 若硝酸恰好反应时,生成硝酸铁的硝酸就是未被还原的硝酸,根据铁离子的物质的量计算未被还原的硝酸的物质的量即可;
若硝酸过量时,除去生成一氧化氮的硝酸就是未被还原的硝酸,根据氧化还原反应中得失电子守恒计算被还原的硝酸,硝酸总量-被还原的硝酸=未被还原的硝酸,据此进行计算.
解答 解:若硝酸恰好反应时,amolFeS与bmolFeO被氧化生成Fe(NO3)3,根据铁原子守恒找出铁原子和硝酸的关系式:
amolFeS+bmolFeO→(amol+bmol)Fe→(amol+bmol)Fe(NO3)3→3(amol+bmol)HNO3,所以未被还原的硝酸的质量=3(amol+bmol)×63g/mol=(a+b)×189g,故②正确;
若硝酸过量时,amolFeS与bmolFeO生成Fe(NO3)3和H2SO4失去的电子数=amol[(3-2)+(6-(-2))]+bmol(3-2)=(9a+b)mol,氧化还原反应中得失电子数相等,所以硝酸得到(9a+b)mol电子生成一氧化氮,一个硝酸分子得到3个电子生成NO,所以被还原的硝酸的物质的量=$\frac{(9a+b)mol}{3}$,未被还原的硝酸的物质的量=(cV-$\frac{9a+b}{3}$)mol,故④正确;
根据分析可知,正确的为②④,
故选B.
点评 本题考查了有关氧化还原反应的计算,题目难度较大,明确讨论法在化学计算中的应用方法,注意本题要结合原子守恒和得失电子守恒进行分析解答.


科目:高中化学 来源: 题型:解答题
 已知V、W、X、Y、Z是原子序数一次增大的短周期主族元素,V、Y在周期表中的相对位置如表所示,V元素与氧元素能形成两种无色气体,X是地壳中含量罪所的金属元素,请回答下列问题:
已知V、W、X、Y、Z是原子序数一次增大的短周期主族元素,V、Y在周期表中的相对位置如表所示,V元素与氧元素能形成两种无色气体,X是地壳中含量罪所的金属元素,请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
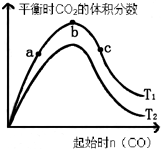 近年来燃煤脱硫技术受到各界科研人员的重视,某脱硫技术涉及如下反应:
近年来燃煤脱硫技术受到各界科研人员的重视,某脱硫技术涉及如下反应:| t/s | 0 | 10 | 20 | 30 | 50 |
| c(CO)mol/L | 3 | 1.8 | 1.2 | 0.9 | 0.9 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2,4,4-三甲基戊烷 | B. | 4-甲基-2-戊烯 | ||
| C. | 4-甲基-5-乙基庚烷 | D. | 1,2,4-三甲基丁烷 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | M | B. | M+ | C. | M2+ | D. | M3+ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 将一定质量的Mg-Al合金投入到100mL一定物质的量浓度的HCl中,合金全部溶解,向所得溶液中滴加5mol/LNaOH溶液至过量,生成沉淀质量与加入NaOH溶液的体积关系如下图所示.
将一定质量的Mg-Al合金投入到100mL一定物质的量浓度的HCl中,合金全部溶解,向所得溶液中滴加5mol/LNaOH溶液至过量,生成沉淀质量与加入NaOH溶液的体积关系如下图所示.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题

 ;
;查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com