
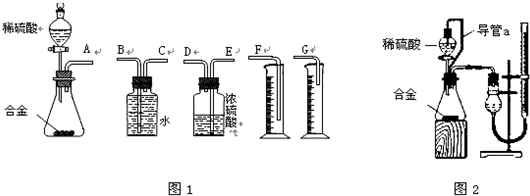
| 7.168L |
| 22.4L/mol |
| 0.2mol×27g |
| 5.88g |


 桃李文化快乐暑假武汉出版社系列答案
桃李文化快乐暑假武汉出版社系列答案 优秀生快乐假期每一天全新寒假作业本系列答案
优秀生快乐假期每一天全新寒假作业本系列答案 暑假接力赛新疆青少年出版社系列答案
暑假接力赛新疆青少年出版社系列答案科目:高中化学 来源: 题型:
| A、煅烧粉碎的黄铁矿矿石有利于SO2的生成 |
| B、硫酸生产中用98%的硫酸吸收SO3,而不用H2O或稀硫酸吸收SO3 |
| C、加入催化剂有利于氨的合成 |
| D、工业制取金属钾Na(l)+KCl(l)?NaCl(l)+K(g)选取适宜的温度,使K变成蒸气从反应混合物中分离出来 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、1molN2所含有的原子数为NA |
| B、标准状况下,22.4L水中含有的水分子数为NA |
| C、标准状况下,22.4L氯化氢所含的原子数为NA |
| D、24gO2分子和24gO3分子所含的氧原子数目相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
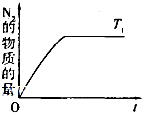 导致空气污染的主要原因来自于化石燃料燃烧、硫酸工业和汽车尾气的排放;致使大量二氧化硫和氮氧化物排入大气中.利用化学反应原理研究治理环境污染的方法是当前环保工作的重要研究内容之一.
导致空气污染的主要原因来自于化石燃料燃烧、硫酸工业和汽车尾气的排放;致使大量二氧化硫和氮氧化物排入大气中.利用化学反应原理研究治理环境污染的方法是当前环保工作的重要研究内容之一.查看答案和解析>>
科目:高中化学 来源: 题型:

| ||
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com