
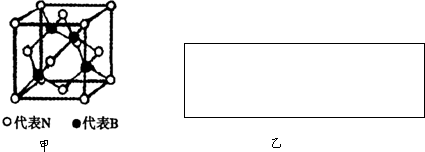
| m |
| V |
| 1 |
| 8 |
| 1 |
| 2 |
| 4×25g |
| NA |
| m |
| V |
| ||
| a3 cm3 |
| 100 |
| a3×NA |
| 100 |
| a3×NA |
 ,
, .
.


科目:高中化学 来源: 题型:
| A、钢铁腐蚀时可能发生的正极反应:2H2O+O2+4e-═4OH- |
| B、向KHSO4溶液中滴入Ba(OH)2溶液使pH=7:SO42-+H++Ba2++OH-═BaSO4↓+H2O |
| C、明矾水解的离子方程式:Al3++3H2O?Al(OH)3+3H+ |
| D、K37ClO3与浓盐酸(HCl)在加热时生成氯气:K37ClO3+6HCl═K37Cl+3Cl2↑+3H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、c(NH4+)相等的(NH4)2SO4溶液和(NH4)2CO3溶液 c[(NH4)2SO4]<[(NH4)2CO3] |
| B、0.1mol/L的HCOOH溶液中:c(HCOO-)+c(OH-)=c(H+) |
| C、0.1mol/L某二元弱酸强碱盐NaHA溶液中:c(Na+)=c(A2-)+c(HA-)+c(H2A) |
| D、10mL0.5mol/L CH3COONa溶液与6mL1mol/L盐酸混合 c(Cl-)>c(Na+)>c(OH-)>c(H+) |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、Na+、K+、Al
| ||||
B、Fe2+、Na+、S
| ||||
C、Mg2+、N
| ||||
D、Ba2+、K+、Cl-、Mn
|
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、①②③④⑤ | B、①③④⑤⑥ |
| C、②③⑤⑥ | D、③④⑤⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com