
【题目】下图每一方框中的字母代表一种反应物或生成物: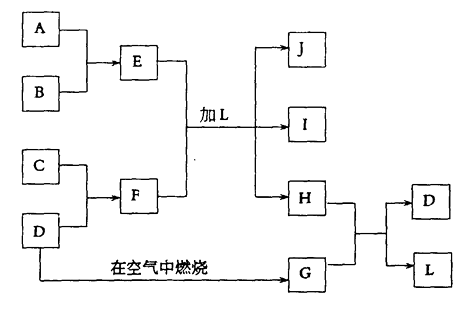
产物J是含A金属元素的胶状白色沉淀,I为NaCl溶液,D是淡黄色固体单质。试填写下列空白:
(1)L的化学式为:
(2)用电子式表示F的形成过程
(3)写出E+F+L=J+I+H反应的离子方程式:
(4)H和G之间反应的化学方程式为: , 每生成2.4克的D转移 mol电子。
【答案】
(1)H2O
(2)![]()
(3)3S2-+2Al3++6H2O=2Al(OH)3↓+3H2S ↑
(4)2H2S+SO2=3S+2H2O;0.1
【解析】(1)中学阶段学习过的淡黄色固体单质为S,则G是二氧化硫,与SO2反应生成S的物质为H2S,二者反应生成S和水;
(2)从“J是含A金属元素的胶状白色沉淀”可初步认定A是铝,J是氢氧化铝;从“I为NaCl溶液”可推出C为钠,F为硫化钠,B为Cl2 , E为AlCl3 , L为H2O,H为H2S,硫化钠是离子化合物,其形成过程可表示为 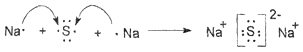 ;
;
(3)根据以上分析可知E+F+L=J+I+H反应的离子方程式为3S2-+2Al3++6H2O=2Al(OH)3↓+3H2S ↑;
(4)SO2具有氧化性,H2S具还原性,二者发生氧化还原反应生成S和H2O,反应的方程式为2H2S+SO2=3S+2H2O,2.4gS是0.075mol,每生成3mol硫,转移4mol电子,所以每生成2.4gS转移0.1mol电子。
故答案为:(1)H2O;(2) ;(3)3S2-+2Al3++6H2O=2Al(OH)3↓+3H2S ↑;(4)2H2S+SO2=3S+2H2O;0.1;
;(3)3S2-+2Al3++6H2O=2Al(OH)3↓+3H2S ↑;(4)2H2S+SO2=3S+2H2O;0.1;
“D是淡黄色固体单质”,则D是S;其在空气中燃烧产物G为SO2;“J是含A金属元素的胶状白色沉淀,I为NaCl溶液”则J为Al(OH)3、A为Al、F为Na2S、C为Na、B为强酸、E为可溶性铝盐、H为H2S、L为H2O。据此结合设问进行作答。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】下图中横坐标为加入反应物的物质的量,纵坐标为产生沉淀的物质的量。下列反应对应的曲线错误的是
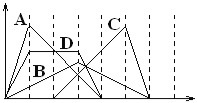
A. 向NaAlO2溶液中滴入HCl至过量
B. 向澄清石灰水中通入CO2至过量
C. 向含有盐酸的A1C13溶液中滴入NaOH溶液至过量。
D. 向含有等物质的量的Ca(OH)2、KOH的混合溶液中通入CO2至沉淀消失
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列化学用语表述正确的是( )
A. 核内质子数为117,核内中子数为174的核素Ts可表示为:174TS
B. 乙醇的结构简式:C2H6O
C. COCl2 的结构式为: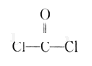
D. CaO2的电子式为:![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氨是化学实验室及化工生产中的重要物质,应用广泛。
(1)已知25℃时:N2(g) + O2(g) ![]() 2NO(g) ΔH = +183kJ/mol
2NO(g) ΔH = +183kJ/mol
2H2(g) + O2(g) = 2H2O(l) ΔH = -571.6 kJ/mol
4NH3(g) + 5O2(g) = 4NO(g) +6H2O(l) ΔH = -1164.4 kJ/mol
则 N2(g) + 3H2(g) ![]() 2NH3(g) ΔH = kJ/mol
2NH3(g) ΔH = kJ/mol
(2)在恒温恒容体系中进行的合成氨反应,下列能说明该反应已达到平衡状态的是___________
A.容器内N2、H2、NH3的浓度之比为1︰3︰2
B.3v(N2)正=v(H2)逆
C.容器内压强保持不变
D.生成1mol N2的同时消耗2molNH3
(3)在恒温恒容密闭容器中进行合成氨反应,起始投料时各物质浓度如下表:
N2 | H2 | NH3 | |
投料Ⅰ | 1.0 mol/L | 3.0 mol /L | 0 |
投料Ⅱ | 0.5 mol/L | 1.5 mol/L | 1.0 mol/L |
①按投料Ⅰ进行反应,测得达到化学平衡状态时H2的转化率为40%,则该温度下合成氨反应的平衡常数K=(只需代入数据,不用计算结果)
②按投料Ⅱ进行反应,起始时反应进行的方向为(填“正向”或“逆向”)
(4)电化学气敏传感器可用于监测环境中NH3的含量,其工作原理示意图如下,写出电极a的电极反应式: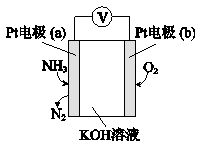
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】计算以下数值(均为25℃时)
(1)某浓度的NH3·H2O溶液中,由水电离的c(H+)=1×10-12mol/L,该溶液的 pH=
(2)将pH=3的H2SO4 溶液和pH=12的NaOH溶液混合, 混合后所得溶液的PH=10,则H2SO4 溶液与NaOH溶液的体积比为
(3)向0.02mol/L的MgCl2溶液中加入NaOH固体,若要生成Mg(OH)2沉淀,溶液的pH最低为(已知Ksp[Mg(OH)2]=3.2×10-11,lg2.5=0.4)
(4)①盐碱地因含较多的 ![]() ,使得土壤呈碱性,不利于作物生长,通过施加适量石膏粉末(主要含有CaSO4 , 微溶于水)来降低土壤的碱性。写出该过程中发生反应的化学方程式
,使得土壤呈碱性,不利于作物生长,通过施加适量石膏粉末(主要含有CaSO4 , 微溶于水)来降低土壤的碱性。写出该过程中发生反应的化学方程式
②SOCl2是一种无色或淡黄色液体,遇水剧烈反应得到二氧化硫和氯化氢,是一种常用的脱水剂。将SOCl2与FeCl36H2O混合并加热,可得到无水FeCl3 , 得到无水FeCl3的化学方程式为
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下面两种气体的原子数一定相等的是( )
A.质量相等,密度不同的氮气和一氧化碳
B.体积相等,密度相等的氮气和氢气
C.在温度相同、体积相等的条件下氧气和氮气
D.在压强相同、体积相等的条件下氧气和氮气
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氧化亚铜(Cu2O)是船舶防污剂的首选,可利用印刷电路板酸性蚀刻液(CuCl42-、Cl-、H+)和碱性蚀刻液[Cu(NH3)42+、NH4+、NH3、Cl-]来制备,工艺流程如下:
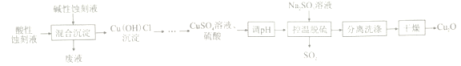
已知:强酸条件下,2Cu+==Cu+Cu2+
(1)不同pH下“混合沉淀”实验结果见下表。由表可知,pH应控制在______左右。
pH | 4.00 | 4.50 | 5.40 | 6.20 | 6.50 | 7.00 | 8.00 | 8.50 |
废液含铜量/g.L-1 | 19.5 | 2.4 | 2.0 | 0.3 | 0.2 | 2.0 | 8.3 | 17.0 |
(2)“混合沉淀”中废液的主要成分为______________(填化学式)
(3)“控温脱硫”生成Cu2O的离子方程式为_________;该过程产生的SO2经_____(填化学式)处理后生成可循环物质Na2SO3。
(4)“控温脱硫”过程中温度对Cu2O的产率影响及SO2在水中溶解度随温度变化如图所示:
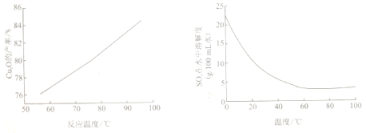
下列说法正确的是_____
a.在60℃以下,温度越高,SO2越易逸出,有利于提高生产中硫原子利用率
b.反应温度的变化是影响Cu2O产率的主要因素
c.结合工业生产实际,温度应控制在溶液呈沸腾状态
d.低温时,Cu2O产率较低与SO2低温时的溶解度较大有关
(5)检验Cu2O是否洗涤干净的方法是______________________________。
(6)某工厂用V1,L含铜量120g·L-1的酸性蚀刻液和V2L含铜量160g·L-1的碱性蚀刻液制备Cu2O,最终得到产品mg,产率为____%。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有三组溶液:①含有水份的植物油中除去水份②回收碘的CCl4溶液中的CCl4③用乙醚浸泡青蒿提取其中的有效成份青蒿素 ④除去食盐溶液中的泥沙。分离以上各混合液的正确方法依次是( )
A.分液、萃取、蒸馏、蒸发B.萃取、蒸馏、分液、过滤
C.分液、蒸馏、萃取、过滤D.蒸馏、萃取、分液、蒸发
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com