
| m |
| 65 |
| n |
| 64 |
| a |
| 64 |
| 65b |
| m+n |
| 65a |
| a+b |
| 2��10-a |
| (10-10.5)2 |
| m |
| 65 |
| n |
| 64 |
| a |
| 64 |
| 65b |
| m+n |
| 65a |
| a+b |
| 65a |
| a+b |
| 2��10-a |
| (10-10.5)2 |



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
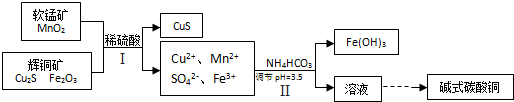
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A������ʵ���У���������������ԭ��Ӧ |
| B������ʵ��֤����ԭ�ԣ�Fe2+��Br-��Cl-��Mn2+ |
| C��ʵ������ɵ����岻��ʹʪ��ĵ���KI��ֽ���� |
| D��ʵ���֤��Fe2+�������������л�ԭ�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
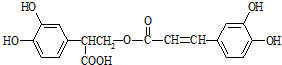 �����ڱ�����Ϊԭ�Ϻϳ��Ե������·��Ϊ��
�����ڱ�����Ϊԭ�Ϻϳ��Ե������·��Ϊ��
| A���л���A����������ԭ��һ����ͬһƽ���� |
| B���л���C��Ũ�������ˮ���һ�ֲ�����B |
| C���л���B���Է���ȡ�����ӳɡ���ȥ��������Ӧ |
| D��1 mol�Ե�����ֱ���������NaOH��Һ��Ũ��ˮ��Ӧ����������NaOH��Br2��Ϊ6 mol |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A��Cu2+��Na+��SO42-��Cl- |
| B��K+��Na+��HCO3-��NO3- |
| C��OH-��HCO3-��Ca2+��Na+ |
| D��Ba2+��Na+��OH-��NO3- |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A��N2O4��NO2�ķ�������Ϊ1��2 |
| B��N2O4��NO2��Ũ����� |
| C����λʱ����1 mol N2O4���ĵ�ͬʱ��2 mol NO2���� |
| D��ƽ����ϵ����ɫ���ٸı� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
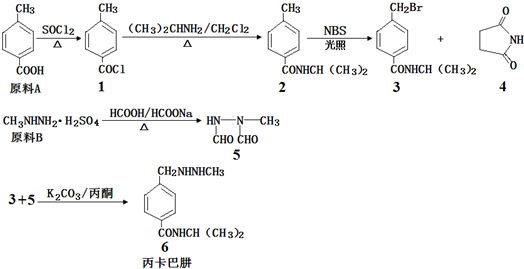
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com