
分析 乙烯含有碳碳双键,可与氢气、水、氯化氢等在一定条件下发生加成反应,分别生成乙烷、乙醇、氯乙烷等,以此解答该题.
解答 解:乙烯与氢气反应发生加成反应生成乙烷,方程式为CH2=CH2+H2$\stackrel{催化剂}{→}$CH3CH3,
乙烯与HCl在一定条件下发生的加成反应的方程式为:CH2=CH2+HCl$\stackrel{催化剂}{→}$CH3CH2Cl,
乙烯分子含有碳碳双键,能与水发生加成反应,反应的方程式为:CH2=CH2+H2O$\stackrel{催化剂}{→}$CH3CH2OH,
故答案为:CH2=CH2+H2$\stackrel{催化剂}{→}$CH3CH3;CH2=CH2+HCl$\stackrel{催化剂}{→}$CH3CH2Cl;CH2=CH2+H2O$\stackrel{催化剂}{→}$CH3CH2OH.
点评 本题考查了乙烯的结构和性质,为高频考点,题目侧重于考查化学方程式的书写,掌握乙烯官能团碳碳双键的性质是书写化学方程式的关键,题目难度不大.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:推断题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 事实 | 解释 |
| A | 用铝罐槽车储运浓硫酸 | 常温下,铝与浓硫酸不反应 |
| B | 在蔗糖中加入浓硫酸后出现发黑 | 浓硫酸具有脱水性 |
| C | 浓硝酸在光照下颜色变黄 | 浓HNO3不稳定,生成的有色产物NO2能溶于浓硝酸 |
| D | SO2能使溴水褪色 | SO2具有还原性 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 该电池的正极为锌 | |
| B. | 该电池的反应中二氧化锰起催化作用 | |
| C. | 当0.1 mol Zn完全溶解时,流经电解液的电子个数约为1.204×1023 | |
| D. | 电池的正极反应式为:2MnO2+2H2O+2e=2MnO(OH)+2OH |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 若某NaOH溶液的温度由25℃→50℃(忽略液体体积的变化),则溶液的pH将减小 | |
| B. | 25℃时,用盐酸滴等浓度的氨水至pH=7,则V(盐酸)>V(氨水) | |
| C. | 将2mol CO2通入到1L 3mol•L-1NaOH溶液中,则溶液中,c(Na+)>c(CO32-)>c(HCO3-)>c(OH-)>c(H+) | |
| D. | 25℃时,pH=12的Na2CO3溶液中,H+的浓度是OH-的浓度的1010倍 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①④⑦⑩ | B. | ①③④⑤⑦⑩ | C. | ①④⑤⑦⑧⑨⑩ | D. | ②③④⑤⑥⑦⑩ |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
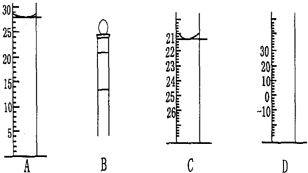
| 滴定序 号 | 待测液体积/mL | 所消耗盐酸标准液的体积/mL | ||
| 滴定前 | 滴定后 | 消耗的体积 | ||
| 1 | V | 0.50 | 25.52 | 25.02 |
| 2 | V | 0.40 | 24.40 | 24.00 |
| 3 | V | 1.00 | 25.98 | 24.98 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
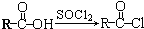 .
.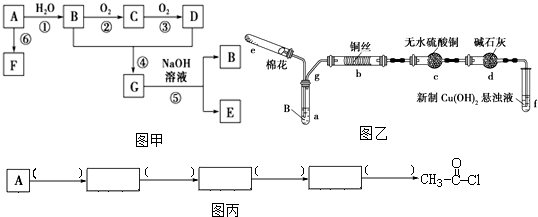
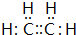 .
.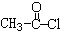 的合成路线如图丙(无机试剂任选).请在( )内填上所需试剂,□内填上合成过程的中间产物.
的合成路线如图丙(无机试剂任选).请在( )内填上所需试剂,□内填上合成过程的中间产物.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com