
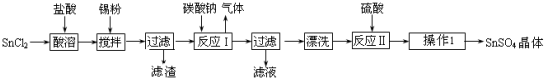
 ŃõŌŖĖŲŗĶĀ±×åŌŖĖŲ¶¼ÄÜŠĪ³É¶ąÖÖĪļÖŹ£¬ĪŅĆĒæÉŅŌĄūÓĆĖłŃ§ĪļÖŹ½į¹¹ÓėŠŌÖŹµÄĻą¹ŲÖŖŹ¶Č„ČĻŹ¶ŗĶĄķ½ā£®
ŃõŌŖĖŲŗĶĀ±×åŌŖĖŲ¶¼ÄÜŠĪ³É¶ąÖÖĪļÖŹ£¬ĪŅĆĒæÉŅŌĄūÓĆĖłŃ§ĪļÖŹ½į¹¹ÓėŠŌÖŹµÄĻą¹ŲÖŖŹ¶Č„ČĻŹ¶ŗĶĄķ½ā£®| ·ś | ĀČ | äå | µā | |
£ØkJ/mol£© | 1681 | 1251 | 1140 | 1008 |
·ÖĪö £Ø1£©COCl2ÖŠCŌ×ӵļŪµē×Ó¶ŌŹżĪŖ$\frac{4+2}{2}$=3£¬CŌ×Ó²ÉČ”sp2Ōӻƣ¬ÖŠŠÄŌ×ÓĪŽ¹Āµē×Ó¶Ō£¬CÓėOŌ×ÓÖ®¼äŠĪ³ÉC=OĖ«¼ü£¬Ęä½į¹¹Ź½ŹĒ £¬¾Ż“ĖÅŠ¶Ļ·Ö×Óæռ乹ŠĶ£¬äåŹĒ35ŗÅŌŖĖŲ£¬×īĶā²ćµē×ÓĪŖĘä¼Ūµē×Ó£¬4sÄܼ¶ÉĻÅÅĮŠ2øöµē×Ó£¬4pÄܼ¶ÉĻÅÅĮŠ5øöµē×Ó£¬¾Ż“ĖŠ“³ö¼Ūµē×ÓÅŲ¼Ź½£»
£¬¾Ż“ĖÅŠ¶Ļ·Ö×Óæռ乹ŠĶ£¬äåŹĒ35ŗÅŌŖĖŲ£¬×īĶā²ćµē×ÓĪŖĘä¼Ūµē×Ó£¬4sÄܼ¶ÉĻÅÅĮŠ2øöµē×Ó£¬4pÄܼ¶ÉĻÅÅĮŠ5øöµē×Ó£¬¾Ż“ĖŠ“³ö¼Ūµē×ÓÅŲ¼Ź½£»
£Ø2£©ŌŚĄė×Ó¾§ĢåÖŠĄė×Ó°ė¾¶Ō½Š”£¬¾§øńÄÜŌ½“󣬾Ż“ĖÅŠ¶Ļ£»
£Ø3£©µŚŅ»µēĄėÄÜŹĒÖøŌ×ÓŹ§Č„Ņ»øöµē×ÓĖłŠčµÄÄÜĮ棬µŚŅ»µēĄėÄÜŌ½Š”£¬¾ĶŌ½ČŻŅ׏§Č„Ņ»øöµē×Ó£¬¾Ż“Ė“šĢā£»
£Ø4£©A£® HClÖŠ“ęŌŚs-p¦Ņ¼ü£¬B£®HFÖŠ“ęŌŚs-p¦Ņ¼ü£¬C£® SO2ÖŠ“ęŌŚp-p¦Š¼ü£¬D£® SCl2ÖŠ“ęŌŚp-p¦Ņ¼ü£¬¾Ż“Ė“šĢā£»
£Ø5£©øł¾ŻÖŠŠÄŌ×ӵļŪ²ćµē×Ó¶ŌŹżČ·¶ØĘäŌӻƷ½Ź½£»µČµē×ÓĢåŹĒ¾ßÓŠĻąĶ¬µÄ¼Ūµē×ÓŹżŗĶĻąĶ¬Ō×ÓŹżµÄĪ¢Į££»
£Ø6£©øł¾Ż¾łĢÆ·ØČ·¶Ø¾§°ūÖŠø÷ÖÖŌ×ÓµÄøöŹż£¬ŌŁČ·¶ØĘä»ÆѧŹ½£¬øł¾ŻĆܶČČ·¶Ø¾§°ūµÄĢå»ż£¬½ų¶ųĒóµĆ¾§°ūµÄ±ß³¤£¬Į½øöĄėµĆ×ī½üµÄøĘŹĒĪ»ÓŚ¶„µćŗĶĆęŠÄÉĻµÄ£¬ĖüĆĒµÄ¾ąĄėĪŖ¾§°ū±ß³¤µÄ$\frac{\sqrt{2}}{2}$£¬¾Ż“Ė“šĢā£®
½ā“š ½ā£ŗ£Ø1£©COCl2ÖŠCŌ×ӵļŪµē×Ó¶ŌŹżĪŖ$\frac{4+2}{2}$=3£¬CŌ×Ó²ÉČ”sp2Ōӻƣ¬ÖŠŠÄŌ×ÓĪŽ¹Āµē×Ó¶Ō£¬CÓėOŌ×ÓÖ®¼äŠĪ³ÉC=OĖ«¼ü£¬Ęä½į¹¹Ź½ŹĒ £¬ĖłŅŌĖüµÄæռ乹ŠĶĪŖĘ½ĆęČż½ĒŠĪ£¬äåŹĒ35ŗÅŌŖĖŲ£¬×īĶā²ćµē×ÓĪŖĘä¼Ūµē×Ó£¬4sÄܼ¶ÉĻÅÅĮŠ2øöµē×Ó£¬4pÄܼ¶ÉĻÅÅĮŠ5øöµē×Ó£¬Ęä¼Ūµē×ÓÅŲ¼Ź½ĪŖ4s24p5£¬
£¬ĖłŅŌĖüµÄæռ乹ŠĶĪŖĘ½ĆęČż½ĒŠĪ£¬äåŹĒ35ŗÅŌŖĖŲ£¬×īĶā²ćµē×ÓĪŖĘä¼Ūµē×Ó£¬4sÄܼ¶ÉĻÅÅĮŠ2øöµē×Ó£¬4pÄܼ¶ÉĻÅÅĮŠ5øöµē×Ó£¬Ęä¼Ūµē×ÓÅŲ¼Ź½ĪŖ4s24p5£¬
¹Ź“š°øĪŖ£ŗĘ½ĆęČż½ĒŠĪ£»4s24p5£»
£Ø2£©ŌŚĄė×Ó¾§ĢåÖŠĄė×Ó°ė¾¶Ō½Š”£¬¾§øńÄÜŌ½“ó£¬±Č½ĻĮ½øö·“Ó¦µÄ²śĪļæÉÖŖ£¬ÓÉÓŚĀČĄė×ӵİė¾¶Š”ÓŚµāĄė×Ó£¬ĖłŅŌCsClµÄ¾§øńÄÜ“óÓŚCsIµÄ¾§øńÄÜ£¬¹Ź“š°øŃ”A£»
£Ø3£©µŚŅ»µēĄėÄÜŹĒÖøŌ×ÓŹ§Č„Ņ»øöµē×ÓĖłŠčµÄÄÜĮ棬µŚŅ»µēĄėÄÜŌ½Š”£¬¾ĶŌ½ČŻŅ׏§Č„Ņ»øöµē×Ó£¬±Č½Ļ±ķøńÖŠµÄŹż¾ŻæÉÖŖ£¬µāøüČŻŅ׊Ī³É½ĻĪČ¶ØµÄµ„ŗĖŃōĄė×Ó£¬¹Ź“š°øĪŖ£ŗµā£»
£Ø4£©A£® HClÖŠ“ęŌŚs-p¦Ņ¼ü£¬B£®HFÖŠ“ęŌŚs-p¦Ņ¼ü£¬C£® SO2ÖŠ“ęŌŚp-p¦Š¼ü£¬D£® SCl2ÖŠ“ęŌŚp-p¦Ņ¼ü£¬
¹Ź“š°øĪŖ£ŗD£»
£Ø5£©ŅņĪŖĀČŌ×ÓÖÜĪ§ÓŠĖĶŌ¼Ū²ćµē×Ó£¬ĖłŅŌÖŠŠÄŌ×ÓµÄŌӻƷ½Ź½ĪŖsp3Ōӻƣ»CN-ÖŠÓŠĮ½øöŌ×Ó£¬¼Ūµē×ÓŹżĪŖ10øö£¬øł¾ŻµČµē×ÓĢåŹĒ¾ßÓŠĻąĶ¬µÄ¼Ūµē×ÓŹżŗĶĻąĶ¬Ō×ÓŹżµÄĪ¢Į£æÉÖŖ£¬ĖüµÄµČµē×ÓĢå·Ö×ÓŹĒN2»ņ CO£¬
¹Ź“š°øĪŖ£ŗsp3Ōӻƣ»N2»ņ CO£»
£Ø6£©øł¾Ż¾łĢÆ·ØæÉÖŖ¾§°ūÖŠøĘĄė×ÓµÄøöŹżĪŖ8”Į$\frac{1}{8}+6”Į\frac{1}{2}$=4£¬¹żŃõĄė×ÓµÄøöŹżĪŖ12”Į$\frac{1}{4}+1$=4£¬¹ŹĘä»ÆѧŹ½ĪŖCaO2£¬Éč¾§°ūµÄ±ß³¤ĪŖa£¬øł¾Ż$¦Ń=\frac{\frac{4”Į£Ø40+32£©}{{N}_{A}}}{{a}^{3}}$£¬µĆa=$\root{3}{\frac{72”Į4}{¦Ń{N}_{A}}}$cm£¬Į½øöĄėµĆ×ī½üµÄøĘŹĒĪ»ÓŚ¶„µćŗĶĆęŠÄÉĻµÄ£¬ĖüĆĒµÄ¾ąĄėĪŖ¾§°ū±ß³¤µÄ$\frac{\sqrt{2}}{2}$±¶£¬¼“ĪŖ$\frac{\sqrt{2}}{2}”Į\root{3}{\frac{72”Į4}{¦Ń{N}_{A}}}$cm£¬
¹Ź“š°øĪŖ£ŗCaO2£»$\frac{\sqrt{2}}{2}”Į\root{3}{\frac{72”Į4}{¦Ń{N}_{A}}}$£®
µćĘĄ ±¾ĢāÖ÷ŅŖæ¼²éŌ×ÓŗĖĶāµē×ÓÅŲ¼”¢¾§øńÄÜ”¢Ō×ÓŌӻƹģµĄ”¢¾§°ūµÄ¼ĘĖćµČÖŖŹ¶µć£¬ÖŠµČÄŃ¶Č£¬½āĢāŹ±×¢Ņā»ł“”ÖŖŹ¶µÄĮé»īŌĖÓĆ£®



| Äź¼¶ | øßÖŠæĪ³Ģ | Äź¼¶ | ³õÖŠæĪ³Ģ |
| øßŅ» | øßŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” | ³õŅ» | ³õŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” |
| ø߶ž | ø߶žĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õ¶ž | ³õ¶žĆā·ŃæĪ³ĢĶĘ¼ö£” |
| øßČż | øßČżĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õČż | ³õČżĆā·ŃæĪ³ĢĶĘ¼ö£” |
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗĢīæÕĢā
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | ŃĪĖį | B£® | ĮņĖį | C£® | BaSO4 | D£® | NH3•H2O |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ¶ąŃ”Ģā
| A£® | NH4+æÉÄÜ“ęŌŚ | |
| B£® | ČōŃęÉ«·“Ó¦²āµĆK+“ęŌŚ£¬ŌņNH4+²»Ņ»¶Ø“ęŌŚ | |
| C£® | Cl-²»æÉÄÜ“ęŌŚ | |
| D£® | Ba2+Ņ»¶Ø²»“ęŌŚ£¬Mg2+æÉÄÜ“ęŌŚ |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ¶ąŃ”Ģā
| A£® | CCTV-8·ØĄ¼ĮÕæØ»¤·ō²śĘ·¹ćøęÖŠ”°ĪŅĆĒŗŽ»Æѧ”±ŃĻÖŲĪ„·“æĘѧ£¬ŅņĘ乤ŅÕæĻ¶ØÓė»Æѧӊ¹Ų | |
| B£® | ÖĒÄÜŹÖ»śÖŠŹ¹ÓƵďÆÄ«Ļ©²»½öŹĒµēŗĶČȵÄĮ¼µ¼Ģ壬»¹ŹĒÓ²¶Č½Ļ“óµÄŠĀŠĶÓŠ»śŗĻ³É²ÄĮĻ | |
| C£® | ²ÉÓĆ“ß»Æ×Ŗ»»¼¼Źõ½«Ęū³µĪ²ĘųÖŠµÄNOxŗĶCO×Ŗ»ÆĪŖĪŽ¶¾ĘųĢå | |
| D£® | ĪŖĮĖÄÜŌö¼ÓĖ®ÖŠŃõĘųµÄŗ¬Į棬Ńų½šÓćÓƵÄ×ŌĄ“Ė®Ņ»°ćĻČŌŚŃō¹āĻĀɹŅ»¶ĪŹ±¼ä |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | ¼ÓČėÉŁĮæµÄNaOH¹ĢĢ壬Na2SČÜŅŗÖŠµÄc£ØNa+£©”¢c£ØS2-£©¾łŌö“ó | |
| B£® | Na2SČÜŅŗÖŠ“ęŌŚ×Å£ŗc£ØOH-£©=c£ØH+£©+c£ØHS-£©+c£ØH2S£© | |
| C£® | Na2SČÜŅŗÖŠĄė×ÓÅØ¶Č¹ŲĻµĪŖ£ŗc£ØNa+£©£¾c£ØOH-£©£¾c£ØS2-£©£¾c£ØH+£© | |
| D£® | Na2SČÜŅŗÖŠ“ęŌŚ×Å£ŗ2c£ØNa+£©=c£ØS2-£©+c£ØHS-£©+c£ØH2S£© |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| X | ||
| Y | Z | W |
| T |
| A£® | X”¢Z”¢WŌŖĖŲµÄŌ×Ó°ė¾¶ŅŌ¼°ĖüĆĒµÄĘųĢ¬Ēā»ÆĪļµÄČČĪČ¶ØŠŌ¾łŅĄ“ĪµŻŌö | |
| B£® | YX2¾§ĢåČŪ»Æ”¢ŅŗĢ¬WX3Ęų»Æ¾łŠčæĖ·ž·Ö×Ó¼ä×÷ÓĆĮ¦ | |
| C£® | øł¾ŻŌŖĖŲÖÜĘŚĀÉ£¬æÉŅŌĶĘ²āTŌŖĖŲµÄµ„ÖŹ¾ßÓŠ°ėµ¼ĢåĢŲŠŌ£¬T2X3¾ßÓŠŃõ»ÆŠŌŗĶ»¹ŌŠŌ | |
| D£® | Y”¢Z”¢WŌŖĖŲŌŚ×ŌČ»½ēÖŠ¾ł²»ÄÜŅŌÓĪĄėĢ¬“ęŌŚ£¬ĖüĆĒµÄ×īøß¼ŪŃõ»ÆĪļµÄĖ®»ÆĪļµÄĖįŠŌŅĄ“ĪµŻŌö |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ½ā“šĢā
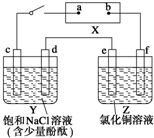 ČēĶ¼ÖŠXŹĒÖ±Į÷µēŌ“£®Y²ŪÖŠc”¢dĪŖŹÆÄ«°ō£¬Z²ŪÖŠe”¢fŹĒÖŹĮæĻąĶ¬µÄĶ°ō£®½ÓĶصēĀ·ŗ󣬷¢ĻÖdø½½üĻŌŗģÉ«£®
ČēĶ¼ÖŠXŹĒÖ±Į÷µēŌ“£®Y²ŪÖŠc”¢dĪŖŹÆÄ«°ō£¬Z²ŪÖŠe”¢fŹĒÖŹĮæĻąĶ¬µÄĶ°ō£®½ÓĶصēĀ·ŗ󣬷¢ĻÖdø½½üĻŌŗģÉ«£®²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | ·“Ó¦2Mg+CO2$\frac{\underline{\;\;”÷\;\;}}{\;}$2MgO+C”÷H£¼0“ÓģŲ±ä½Ē¶Čæ“£¬æÉ×Ō·¢½ųŠŠ | |
| B£® | ŌŚĆܱÕČŻĘ÷·¢ÉśæÉÄę·“Ó¦£ŗ2NO£Øg£©+2CO£Øg£©?N2£Øg£©+2CO2£Øg£©”÷H=-113.0 kJ/mol£¬“ļµ½Ę½ŗāŗ󣬱£³ÖĪĀ¶Č²»±ä£¬ĖõŠ”ČŻĘ÷Ģå»ż£¬ÖŲŠĀ“ļµ½Ę½ŗāŗ󣬔÷H±äŠ” | |
| C£® | ŅŃÖŖ£ŗKsp£ØAgCl£©=1.8”Į10-10£¬Ksp£ØAg2CrO4£©=2.0”Į10-12£¬½«µČĢå»żÅضČĪŖ1.0”Į10-4mol/LµÄAgNO3ČÜŅŗµĪČėµ½ÅØ¶Č¾łĪŖ1.0”Į10-4mol/LµÄKClŗĶK2CrO4µÄ»ģŗĻČÜŅŗÖŠ²śÉśĮ½ÖÖ²»Ķ¬³Įµķ£¬ĒŅAg2CrO4³ĮµķĻČ²śÉś | |
| D£® | øł¾ŻHClOµÄKa=3.0”Į10-8£¬H2CO3µÄKa1=4.3”Į10-7£¬Ka2=5.6”Į10-11£¬æÉĶĘ²āĻąĶ¬×“æöĻĀ£¬µČÅØ¶ČµÄNaClOÓėNa2CO3ČÜŅŗÖŠ£¬pHĒ°Õߊ”ÓŚŗóÕß |
²éæ““š°øŗĶ½āĪö>>
°Ł¶ČÖĀŠÅ - Į·Ļ°²įĮŠ±ķ - ŹŌĢāĮŠ±ķ
ŗž±±Ź”»„ĮŖĶųĪ„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±ØĘ½ĢØ | ĶųÉĻÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | µēŠÅÕ©Ę¾Ł±Ø×ØĒų | É꥜Ź·ŠéĪŽÖ÷ŅåÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | ÉęĘóĒÖČؾŁ±Ø×ØĒų
Ī„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±Øµē»°£ŗ027-86699610 ¾Ł±ØÓŹĻä£ŗ58377363@163.com