
 �����ᱽ������Ҫ���л��ϳ��м��壬��ҵ���ö�����ͪ�Ʊ������ᱽ����
�����ᱽ������Ҫ���л��ϳ��м��壬��ҵ���ö�����ͪ�Ʊ������ᱽ����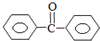 $��_{ŨH_{2}SO_{4}��CH_{3}COOH}^{K_{2}S_{2}O_{8}}$
$��_{ŨH_{2}SO_{4}��CH_{3}COOH}^{K_{2}S_{2}O_{8}}$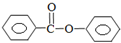
���� ��1������1�������ӷ���ŨH2SO4��40mL�������Ϸ��ȣ�
��2������2��������ͪΪ�л���������л��ܼ����ȼ��飬����Ũ������ȣ����õ�Ž���������4��5���ӣ�ʹŨH2SO4�������ᡢ������س�ֻ�ϣ�Ϊ�����¶Ȳ�����15�棬������ͪ�����ȼ�����Һ�ֶ���������룬�����Ͻ��裻
��3������3�������ᱽ����ˮ�⣬��ˮ������1mL��ԭ����ˮ���˱����ᱽ��ˮ�⣬���Ͳ��ʣ���ˮ��Ũ�����γ���Һ���ȣ������¶ȹ��ߣ����Ͳ��ʣ�
��4������4������������ˮ��ʹ����ƿ�е�ѹǿ���ͣ��ﵽ��Һ�����Ŀ�ģ������õ���©������Ϊ����©����
��5��Ũ���������ˮ�ԣ���ʹ�л�����ˮ̼������ͨ�����˳�ȥ�ù��壮
��� �⣺��1��������Ϊ���������ᣬ�ӷ���ŨH2SO4��40mL�������Ϸ��ȣ�����1����20mLŨH2SO4��40mL����������ͼװ�õ��ձ��п�����5�����»�ϣ���ֹ��ֹҺ�彦�������ٱ�����Ļӷ���
�ʴ�Ϊ����ֹҺ�彦�������ٱ�����Ļӷ���
��2������2�����õ�Ž���������4��5���ӣ�ʹŨH2SO4�������ᡢ������س�ֻ�ϣ��õ�����Һ��ҪΪ����Һ��������ͪΪ�л���������л��ܼ����ȼ��飬��������ͪ9.1g�������ȼ�����γɶ�����ͪ�����ȼ�����Һ��Ũ�����ܶȴ�����ͪ�����ȼ�����Һ����ŨH2SO4�������ᡢ������ػ����Һ���ȣ�����Ϊ�����¶Ȳ�����15�棬����Һ�м��������ͪ�����ȼ�����Һ�ķ����ǣ�����������룬���Ͻ��裬
�ʴ�Ϊ������������룬���Ͻ��裻
��3������3�����ɫҺ���м�ˮ��ֱ��Һ���ɫ��ʧ����ˮ������1mL������ˮ���˱����ᱽ��ˮ��࣬���Ͳ��ʣ���ˮ��Ũ�����γ���Һ���ȣ������¶ȹ��ߣ����Ͳ��ʣ�
�ʴ�Ϊ����ˮ��ʹ�����ᱽ��ˮ�⣬���Ͳ��ʣ������¶ȹ��ߵȣ���
��4������4����ѹ����Ҳ�Ƴ��˻����ˣ������õ���©������Ϊ����©����
�ʴ�Ϊ������©����
��5�������Ʊ�������Һ���������ֺ�ɫ�������Ϊ̼����ΪŨ���������ˮ�ԣ��ܽ��л�����ˮ̼�������ò���©��ͨ�������ᴿ��
�ʴ�Ϊ����Ũ���������·�Ӧ��̼���Ľ�������ˣ�
���� ���⿼���л��ﱽ���ᱽ���ĺϳɼ������ķ��룬��ȷ��Ӧԭ�������ʵ����ʡ������ķ���ԭ���ǽ����Ĺؼ�����Ŀ�Ѷ��еȣ�



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ÿ����1molH2��g���ͷ�483.6kJ������ | |
| B�� | ÿ����1molH2O��g���ͷ�483.6kJ������ | |
| C�� | ����ʽ��H2��g���������ı��Hֵ���� | |
| D�� | ͬ������2molH2O��g����ȫ�ֽ����յ�����Ϊ483.6kJ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
 ͭ�dz����ı�۽�����Ϊ�˱Ƚ���һ��ͭ��������ͭ���ȶ��ԣ����о�����ͭ�������ԣ�ij��ѧС���ͬѧ����������ʵ�飮
ͭ�dz����ı�۽�����Ϊ�˱Ƚ���һ��ͭ��������ͭ���ȶ��ԣ����о�����ͭ�������ԣ�ij��ѧС���ͬѧ����������ʵ�飮�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����

| A�� | B�缫������ԭ��Ӧ | |
| B�� | A�缫�Ϸ�����һ���缫��ӦΪ��2Li++S8+2e-�TLi2S8 | |
| C�� | ÿ����1mol Li2S8ת��0.25mol���� | |
| D�� | ���Ӵ�B�缫�������·����A�缫���پ������������B�缫 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | SO2�ڴ���������������H2SO4��2SO2+O2+2H2O�T4H++2SO42- | |
| B�� | ����SO2��NaOH��Һ��Ӧ�����ӷ���ʽ�ǣ�SO2+OH-�THSO3- | |
| C�� | NaOH��Һ�������չ���SO2�Ĺ������У�SO2+SO32-+H2O�T2HSO3- | |
| D�� | n��SO2����n��NaOH��=1��2ʱ����ҺpH��7��SO32-+H2O?HSO3-+OH- |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
 ȼú��Ϊ����SO2���ŷţ��ɲ�ȡ�Ĵ�ʩ�ǣ�
ȼú��Ϊ����SO2���ŷţ��ɲ�ȡ�Ĵ�ʩ�ǣ��鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | 40% | B�� | 50% | C�� | 80% | D�� | 90% |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | һ������Mg+��Al3+��Cl-������K+��NH4+ | |
| B�� | һ������K+��Mg2+��Cl-������NH4+�����ܺ���Al3+ | |
| C�� | c��Mg2+��=1.00mol•L-1��c��Cl-��=4.00mol•L-1 | |
| D�� | c��K+��=0.50mol•L-1��c��Al3+��=1.00mol•L-1 |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com