
主要用于煤矿井下急救。某兴趣小组拟选用如下装置制备超氧化钾(部分夹持仪器已略去)。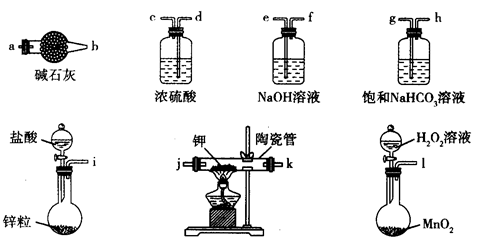
请回答下列问题:
(1)请选择必要的装置,按气流方向的连接顺序为_____________(填仪器接口的字母)。
(2)请根据完整的实验装置,完成下列实验步骤:①_____________________;②装入药品,打开分液漏斗活塞;③持续通入气体一段时间后,点燃酒精灯进行反应;④反应结束后,熄灭酒精灯,待反应管冷却至室温,停止通入氧气,并关闭分液漏斗的活塞;⑤拆除装置,取出产物。
(3)数据记录如下:
根据数据计算可得实验式KOx,则x=____________________。
(4)超氧化钾可吸收二氧化碳,并生成氧气,因此可以作为飞船、潜艇等密闭系统的氧气再生剂。写出超氧化钾与二氧化碳反应的化学方程式:__________________________。与过氧化钠相比,其优点是______________________________。
(1)lefdejka(jk可互换) (2分)
(2)检测装置的气密性(2分)
(3)1.75(2分)
(4)4KO2+2CO2=2K2CO3+3O2(2分)相同质量的过氧化钠和超氧化钾相比,朝氧化钾释放的氧气多。(2分)
解析试题分析:(1)根据超氧化钾(KO2),容易与空气中的水、二氧化碳等发生反应,因此制备的过程中一定要把装置所含的水和二氧化碳除去,进入到陶瓷管中的气体应先经过氢氧化钠溶液除二氧化碳,再经过浓硫酸干燥,陶瓷管后面也要接一个装有碱石灰的干燥管,防空气中的水和二氧化碳与超氧化钾接触,故顺序为:lefdejka(jk可互换);(2) 第一步应为检查装置的气密性;(3)钾的物质的量为:(15.19-14.80)/39=0.01mol,氧的物质的量=(15.47-5.19)/16=0.175mol,所以X=0.175mol/0.01mol=1.75;(4)过氧化钠与CO2反应的方程式为2Na2O2+2CO2=2NaCO3+O2,KO2与CO2反应的方程式为4KO2+2CO2=2K2CO3+3O2,故其优点是相同质量的过氧化钠和超氧化钾相比,朝氧化钾释放的氧气多。
考点:考查氧化还原反应及计算、化学实验基本操作等知识点。


科目:高中化学 来源: 题型:实验题
(18分)甲、乙两个研究性学习小组为测定氨分子中氮、氢原子个数比,设计了如下实验流程:
实验中,先用制得的氨气排尽洗气瓶前所有装置中的空气,再连接洗气瓶和气体收集装 置,立即加热氧化铜。反应完成后,黑色氧化铜转化为红色的铜。下图A、B、C为甲、乙两小组制取氨气时可能用到的装置,D为盛有浓硫酸的洗气瓶。
甲小组测得:反应前氧化铜的质量m1 g、氧化铜反应后剩余固体的质量m2g、生成氮气在标准状况下的体积V1L。乙小组测得:洗气前装置D的质量m3g、洗气后装置D的质量为m4g、生成氮气在标准状况下的体积V2L。请回答下列问题:
(1)检查A装置气密性的操作是____________________________________________________。
(2)实验室检验氨气的操作和现象是____________________________________。
(3)甲、乙两小组选择了不同的方法制取氨气,请将实验装置的字母编号和制备制备原理填写在下表的空格中。
| | 实验装置 | 实验药品 | 制备原理 |
| 甲小组 | A | 氢氧化钙、硫酸铵 | 反应的化学方程式为____________ |
| 乙小组 | _____ | 浓氨水、氢氧化钠 | 用化学平衡原理分析氢氧化钠的作用:_______ |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
某研究性学习小组,为了探究过氧化钠的强氧化性,设计了如图的实验装置。
实验步骤及现象如下:
①检查装置气密性后,装入药品并连接仪器。
②缓慢通入一定量的N2后,将装置D连接好(导管末端未伸入集气瓶中),再向圆底烧瓶中缓慢滴加浓盐酸,反应剧烈,产生黄绿色气体。
③一段时间后,将导管末端伸入集气瓶中收集气体。装置D中收集到能使带火星的木条复燃的无色气体。
④反应结束后,关闭分液漏斗的活塞,再通入一定量的N2,至装置中气体无色。
回答下列问题:
(1)装置B中的湿润的红色纸条褪色,证明A中反应有________(填化学式)生成。若B中改放湿润的淀粉KI试纸,仅凭试纸变蓝的现象不能证明上述结论,请用离子方程式说明原因___________________________________________。
(2)装置C的作用是____________________________________________。
(3)甲同学认为O2是Na2O2被盐酸中的HCl还原所得。乙同学认为此结论不正确,他可能的理由为①________;②________。
(4)实验证明,Na2O2能与干燥的HCl反应,完成并配平该化学方程式。
该反应________(填“能”或“不能”)用于实验室快速制取纯净的Cl2,理由是____________________________________________(要求答出要点)。
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
氢化钙(CaH2)固体是登山运动员常用的能源提供剂。氢化钙要密封保存,一旦接触到水就发生反应生成氢氧化钙和氢气。氢化钙通常用氢气与金属钙加热制取,图1是模拟制取装置:
(1)装置B的作用是 ;装置D的作用是 ;
(2)利用图1实验装置进行实验,实验步骤如下:检查装置气密性后装入药品;打开分液漏斗活塞, (请按正确的顺序填入下列步骤的序号)。
①加热反应一段时间 ②收集气体并检验其纯度
③关闭分液漏斗活塞 ④停止加热,充分冷却
(3)为了确认进入装置C的氢气已经干燥,应在B、C之间再接一装置,该装置中加入的试剂是: 。
(4)甲同学设计一个实验,测定上述实验中得到的氢化钙的纯度(杂质中不含钙元素。请完善下列实验步骤:
①样品称量;②加入________溶液(填化学式),搅拌、过滤;③________(填操作名称);④_______ (填操作名称); ⑤称量碳酸钙。
(5)乙同学利用注射器测量氢化钙和水反应氢气体积的方法,测定上述实验中得到的氢化钙的纯度。他称取46 mg 所制得的氢化钙样品,记录开始时注射器活栓停留在10.00mL刻度处,反应结束后充分冷却,活栓最终停留在57.04mL刻度处(上述气体体积均在标准状况下测定)。试通过计算求样品中氢化钙的纯度: 。
(6)请你再设计一种氢化钙纯度的测定方法: 。
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
Ⅰ.(1)某化学兴趣小组欲从下列装置中选取必要的装置制取(NH4)2SO4溶液,连接的顺序(用接口序号字母表示)是:a 。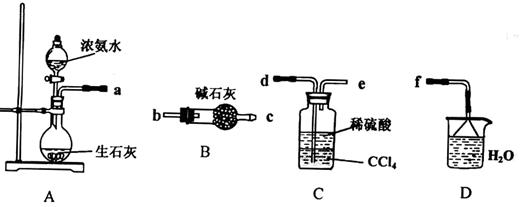
(2)将装置C中两种液体分离开的操作名称是___ __。装置D的作用是 。
Ⅱ.过氧化钙可以用于改善地表水质、处理含重金属粒子废水和治理赤潮,也可用于应急供氧等。工业上生产过氧化钙的主要流程如下: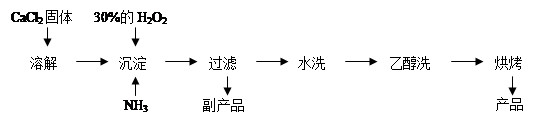
已知CaO2·8H2O呈白色,微溶于水。I2+2S2O32-= 2I-+S4O62-
(1)用上述方法制取CaO2·8H2O的化学方程式是 ;
(2)检验“水洗”是否合格的方法是 ;
(3)测定产品中CaO2的含量的实验步骤是:
第一步:准确称取a g产品于锥形瓶中,加入适量蒸馏水和过量的b g KI晶体,再滴入少量2 mol/L的H2SO4溶液,充分反应。
第二步:向上述锥形瓶中加入几滴淀粉溶液。
第三步:逐滴加入浓度为c mol·L—1的Na2S2O3溶液至反应完全,消耗Na2S2O3溶液V mL。
①判断此滴定实验达到终点的方法是: 。
②CaO2的质量分数为 (用字母表示);
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
实验室常用MnO2与浓盐酸反应制备Cl2(反应装置如图所示)。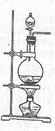
(1)制备实验开始时,先检查装置气密性,接下来的操作依次是__________(填序号)。
A.往烧瓶中加入MnO2粉末 B.加热 C.往烧瓶中加入浓盐酸
制备反应会因盐酸浓度下降而停止。为测定已分离出过量MnO2后的反应残余液中盐酸的浓度,探究小组同学提出的下列实验方案:
甲方案:与足量AgNO3溶液反应,称量生成的AgCl质量。
乙方案:与已知量CaCO3(过量)反应,称量剩余固体的质量。
丙方案:与足量Zn反应,测量生成的H2体积。
继而进行下列判断和实验:
(2)判定甲方案不可行,理由是______________________________________________________。
(3)乙方案的实验发现,固体中含有MnCO3,说明碳酸钙在水中存在__________________,测定的结果会:______________________(填“偏大”、“偏小”或“准确”)。
进行丙方案实验:装置如图所示(夹持器具已略去)。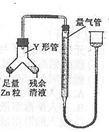
(4)使Y形管中的残余清液与锌粒反应的正确操作是将________转移到______中。
(5)反应完毕,每间隔1分钟读取气体体积,发现气体体积逐渐减小,直至不变。 气体体积逐次减小的原因是____________(排除装置和实验操作的影响因素)。
(6)小组内又有同学提出还可采用酸碱中和滴定法测定残余液中盐酸的浓度,但还需经查阅资料知道:________________________________________________________ 。
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
化学实验有助于理解化学知识,形成化学观念,提高探究与创新能力,提升科学素养。
(1)在实验室中用浓盐酸与MnO2共热制取Cl2并进行相关实验。
①写出该反应的离子方程式_________________________;
②下列收集Cl2的装置正确装置是_________________________;
③将Cl2通入水中,所得溶液中具有氧化性的含氯粒子是________________________;
④设计实验比较Cl2和Br2的氧化性,操作与现象是:取少量新制氯水和CCl4于试管中,____________
_______________________________________________________________________________________。
(2)某化学兴趣小组为了探究AgNO3的热稳定性,设计了如下实验。
用下图所示的实验装置A加热AgNO3固体,产生红棕色气体,在装置D中收集到无色气体。当反应结束以后,试管中残留固体为黑色。
①装置B的作用是___________________________。
②经小组讨论并验证该无色气体为O2,其验证方法是_____________________。
【查阅资料】Ag2O和粉末的Ag均为黑色;Ag2O可溶于氨水。
【提出假设】试管中残留的黑色固体可能是:i Ag;ii Ag2O;iii Ag和Ag2O
| 实验编号 | 操作 | 现象 |
| a | 加入足量氨水,振荡 | 黑色固体不溶解 |
| b | 加入足量稀硝酸,振荡 | 黑色固体溶解,并有气体产生 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
亚铁盐中,FeSO4?7H2O露置于空气中易被氧气氧化,而莫尔盐[(NH4)2SO4?FeSO4?6H2O]露置于空气中不易被氧气氧化,是一种重要的定量分析试剂。其制备原理是:FeSO4+(NH4)2SO4+6H2O =(NH4)2SO4?FeSO4?6H2O。
实验室用废铁屑制备莫尔盐的过程如下:
(1)步骤I除锈的操作是:将废铁屑放入烧杯, ,过滤,洗涤。
(2)步骤II铁屑的溶解在锥形瓶中进行,并水浴加热到60℃左右,需要的仪器是铁架台、石棉网、大烧杯、 。
(3)步骤III中加入的(NH4)2SO4与溶液中FeSO4的物质的量需满足的关系为:n[(NH4)2SO4]∶n[FeSO4]= 。
为了确定(NH4)2SO4的用量,下列方法简便可行的是 (填编号)。
A.称量废铁屑的质量,推算所需(NH4)2SO4的质量
B.称量无锈铁屑和步骤II之后剩余铁屑的质量,推算所需(NH4)2SO4的质量
C.测定FeSO4溶液的浓度和体积,推算所需(NH4)2SO4的质量
(4)所得晶体样品中可能混有的杂质是FeSO4·7H2O和(NH4)2SO4中的一种。某小组设计了如下方案进行检验和测定,请在答题卡上完成表中内容。
| 序号 | 实验方案 | 实验现象和结论 |
| 步骤1 | 取少量样品 | 样品颜色可能有变化。 |
| 步骤2 | 步骤1后将样品转移到试管中,加入去氧蒸馏水,振荡溶解,调节至酸性,________ ___________ __ 。 | 若 ,说明样品中含有FeSO4·7H2O杂质。 |
| 步骤3 | 若步骤2证明样品不含FeSO4?7H2O杂质,再另取样品测定其中NH4+的质量分数w1与理论值w2比较。 | 若w1 w2,说明样品中含有(NH4)2SO4杂质。 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
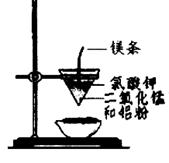
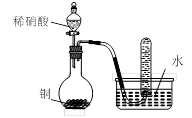
用下图所示装置进行实验,不能达到实验目的的是:( )
甲 乙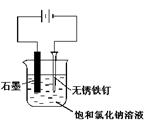
丙 丁
| A.用甲装置比较硫、碳、硅三种元素的非金属性强弱 |
| B.用乙装置可制得金属锰,用同样的装置可制得金属铬 |
| C.用丙装置可实现对铁钉的保护 |
| D.用丁装置验证铜与稀硝酸反应的气体产物只有NO |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com