
【题目】【题目】氯离子插层镁铝水滑石[Mg2Al(OH)6Cl·xH2O]是一种新型离子交换材料,其在高温下完全分解为MgO、Al2O3、HCl和水蒸气。现用下图装置进行实验确定其化学式(固定装置略去)。
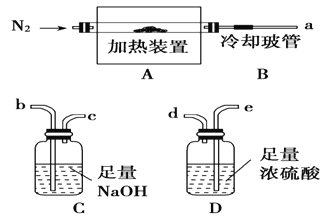
(1)Mg2Al(OH)6Cl·xH2O热分解的化学方程式___________________________。
(2)若只通过测定装置C、D的增重来确定x,则装置的连接顺序为________(按气流方向,用接口字母表示),其中C的作用是________。装置连接后,首先要进行的操作的名称是________。
(3)加热前先通N2排尽装置中的空气,称取C、D的初始质量后,再持续通入N2的作用是______________________、_________________等。
(4)完全分解后测得C增重3.65 g、D增重9.90 g,则x=________。若取消冷却玻管B后进行实验,测定的x值将________(填“偏高”或“偏低”)。
(5)上述水滑石在空气中放置时易发生反应生成[Mg2Al(OH)6Cl1-2y·(CO3)y·zH2O],该生成物能发生类似的热分解反应。现以此物质为样品,用(2)中连接的装置和试剂进行实验测定z,除测定D的增重外,至少还需测定___________。
【答案】 2[Mg2Al(OH)6Cl·xH2O==4MgO+Al2O3+2HCl↑+(5+2x)H2O↑ aedb 吸收HCl气体 检查气密性 将分解产生的气体全部带入装置C、D中完全吸收 防止产生倒吸 3 偏低 装置C的增重及样品质量(样品质量及样品分解后残余物质量或装置C的增重及样品分解后残余物质量)
【解析】(1)从题目可以知道,[Mg2Al(OH)6Cl·xH2O]在高温下完全分解为MgO+Al2O3+HCl和水蒸气,分解产物已经确定,配平即可得到化学方程式。
(2)x是结晶水的系数,确定x需要测定分解产物中水蒸气的质量及![]() 气体的质量,则需先用浓硫酸来吸收尾气中的水蒸气,然后NaOH吸收HCl,通过浓硫酸的增重来计算水蒸气,再通过NaOH溶液的增重来计算HCl,且顺序不能颠倒,因为尾气先经NaOH溶液会带出部分水蒸气,造成较大误差,故连接顺序为aedb;NaOH与酸性气体HCl发生反应,故C的作用是吸收HCl气体;这个反应有大量气体生成,实验前必须检查实验装置的气密性,故首先要进行的操作的名称是检查气密性。
气体的质量,则需先用浓硫酸来吸收尾气中的水蒸气,然后NaOH吸收HCl,通过浓硫酸的增重来计算水蒸气,再通过NaOH溶液的增重来计算HCl,且顺序不能颠倒,因为尾气先经NaOH溶液会带出部分水蒸气,造成较大误差,故连接顺序为aedb;NaOH与酸性气体HCl发生反应,故C的作用是吸收HCl气体;这个反应有大量气体生成,实验前必须检查实验装置的气密性,故首先要进行的操作的名称是检查气密性。
(3)N2不会与体系的任一物质发生反应,故持续通入N2能把分解的气体全部带入装置C、D,另外,反应中产生的气体都被吸收,容易造成倒吸,持续通入![]() 能防止产生倒吸。
能防止产生倒吸。
(4)由化学方程式可知水蒸气和HCl气体的比例关系为: ![]() ,故x=3;若取消冷却玻管B后进行实验,温度过高的水蒸气会影响装置D浓硫酸的吸收,由比例关系式:
,故x=3;若取消冷却玻管B后进行实验,温度过高的水蒸气会影响装置D浓硫酸的吸收,由比例关系式: ![]() 可知,x的值会偏低。
可知,x的值会偏低。
(5)[Mg2Al(OH)6Cl1-2y·(CO3)y·zH2O]与[Mg2Al(OH)6Cl·xH2O]的高温分解反应类似,但还有无法用上述装置测量的H2,故除了装置D的增重,还需测量另外两个变化量,如测量样品质量、样品分解后残余物质量和装置C的增重,故还需测量装置C的增重及样品质量(样品质量及样品分解后残余物质量或装置C的增重及样品分解后残余物质量)。


 口算能手系列答案
口算能手系列答案科目:高中化学 来源: 题型:
【题目】氧锰八面体纳米棒(OMS-2)是一种新型的环保催化剂。用软锰矿和黄铁矿(主要成分分别为MnO2、FeS2)合成OMS-2的工艺流程如下:
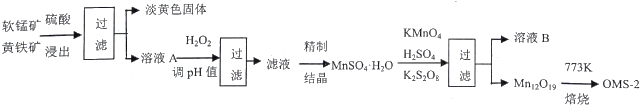
(1)FeS2中硫元素的化合价是_________。“调pH并过滤”主要除去______元素。
(2)Mn12O19中氧元素化合价均为-2价,锰元素的化合价有两种,则Mn (Ⅲ)、Mn (Ⅳ) 物质的量之比为_______________。生产过程中的原料KMnO4、K2S2O8、MnSO4·H2O按物质的量比1:1:5反应,产物中硫元素全部以SO42-的形式存在,该反应的离子方程式为__________________________。
(3)溶液B可进一步分离出两种主要化合物,一种可在该工艺中循环使用,化学式是____________;另一种为盐类,在农业生产中可用作___________________________。
(4)OMS-2是一种纳米级的分子筛。分别用OMS-2和MnOx对甲醛进行催化氧化,在相同时间内甲醛转化率和温度的关系如图:
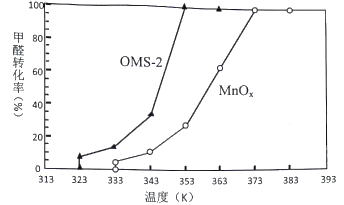
由图可知,OMS-2与MnOx相比,催化效率较高是____________________,原因是________________。
(5)甲醛(HCHO)在OMS-2催化氧化作用下生成CO2和H2O,现利用OMS-2对某密闭空间的甲醛进行催化氧化实验,实验开始时,该空间内甲醛含量为1.22mg/L,CO2含量为0.590mg/L,一段时间后测得CO2含量升高至1.25mg/L,该实验中甲醛的转化率为_______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CaCO3的摩尔质量为100gmol —1。将5.0gCaCO3固体完全溶于稀盐酸后,再用蒸馏水稀释成100ml溶液。该溶液中Ca2+的物质的量浓度为
A.5.0 molL—1 B.0.10 molL—1 C.1.0 molL—1 D.0.50 molL—1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】N2H4是一种高效清洁的火箭燃料.0.25mol N2H4(g)完全燃烧生成氮气和气态水时,放出133.5kJ热量.则下列热化学方程中正确的是( )
A.![]() N2H4(g)+
N2H4(g)+ ![]() O2(g)=
O2(g)= ![]() N2(g)+H2O(l)△H=+267kJmol﹣1
N2(g)+H2O(l)△H=+267kJmol﹣1
B.N2H4(g)+O2(g)=N2(g)+2H2O(l)△H=﹣133.5kJmol﹣1
C.N2H4(g)+O2(g)=N2(g)+2H2O(g)△H=+534kJmol﹣1
D.N2H4(g)+O2(g)=N2(g)+2H2O(g)△H=﹣534kJmol﹣1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】固体氧化物燃料电池是由美国西屋(Westinghouse)公司研制开发的.它以固体氧化锆一氧化钇为电解质,这种固体电解质在高温下允许氧离子(O2﹣)在其间通过.该电池的工作原理如图所示,其中多孔电极a、b均不参与电极反应.下列判断正确的是( ) 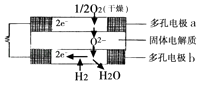
A.该电池的总反应方程式为:2H2+O2=2H2O
B.电子由a极流向b极
C.a极对应的电极反应式为2H2O+O2﹣4e=4OH﹣
D.有O2参加反应的a极为电池的阳极
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮及其化合物在生活和生产中应用广泛。
I.(1)N2O是一种典型的温空气体,在一定条件下,其分解的化学方程式为:2N2O(g)==2N2(g) +O2(g) △H________________。
(2)已知一定条件下有下列反应:
①2N2O5(g)![]() 4NO2(g)+ O2(g) △H1
4NO2(g)+ O2(g) △H1
②2NO2(g)![]() 2NO(g)+ O2(g) △H2
2NO(g)+ O2(g) △H2
③2NaOH(aq)+ N2O5(g)![]() 2NaNO3(aq)+H2O(1) △H3
2NaNO3(aq)+H2O(1) △H3
写出NO与O2的混合物溶于NaOH 溶液生成硝酸盐的热化学方程式_____________________________。在容积为2L 的恒容密闭容器中充入1.00mol N2O5,假设在T℃时只发生反应①、②,若达到平衡状态后O2 为1.00mol,NO2为0.400mol,则T℃时反应①的平衡常数的值为_______________________。
II.联氨(N2H4)是一种绿色环保的还原剂,其氧化产物为氮气。
(3)联氨为二元弱碱,在水中的电离方式与氨相似,写出联氨与过量盐酸反应的离子方程式_______________。
(4)在高温下,N2H4可完全分解为NH3、N2及H2,实验测得分解产物中N2与H2的物质的量之比为3:2,则该分解反应的化学方程式为_____________________________________。
(5)SCR法是工业上消除氮氧化物的常用方法,反应原理为:4NH3(g) +4NO(g) +O2(g) ![]() 4N2(g) +6H2O(g)△H<0其他条件相同,某2L密闭容器中分别投入2mol NH3、2molNO、lmolO2,在甲、乙两种催化剂作用下,NO转化率与温度的关系如图所示。下列叙述不正确的是_________。
4N2(g) +6H2O(g)△H<0其他条件相同,某2L密闭容器中分别投入2mol NH3、2molNO、lmolO2,在甲、乙两种催化剂作用下,NO转化率与温度的关系如图所示。下列叙述不正确的是_________。

A.在催化剂甲作用下,图中Y点处(210℃) NO的转化率一定不是该温度下的平衡转化率
B.在催化剂甲作用下,高于210℃时,NO转化率降低的原因可能是催化剂活性降低
C.300℃时,NO的平衡转化率M点高于Z点的原因是乙催化剂催化效率高
D.其他条件不变,增加NH3的浓度,正反应速率增大,逆反应速率减小,平衡向正反应方向移动
III.NH3是一种重要的化工原料。
(6)NH3和Cr2O3 固体高温下可以制备多功能材料CrN晶体,其反应为Cr2O3 (s) +2NH3(g) ![]() 2CrN(s)+3H2O(g)。在800℃时,为降低相同时间内收集到的粗产品中氧的含量,通过提高反应器中NH3(g)流量的工艺手段达成,请解释可能的原因_____________________________________________。
2CrN(s)+3H2O(g)。在800℃时,为降低相同时间内收集到的粗产品中氧的含量,通过提高反应器中NH3(g)流量的工艺手段达成,请解释可能的原因_____________________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com