
下列事实不能用勒沙特列原理解释的是( )
A.由H2、I2蒸气、HI组成的平衡体系加压后颜色变深
B.增大压强,有利于SO2和O2反应生成SO3
C.用排饱和食盐水法收集Cl2
D.工业制取金属钾Na(l)+ KCl(l)  NaCl(l)+ K(g)选适宜的温度,使K成蒸气从反应混合物中分离出来
NaCl(l)+ K(g)选适宜的温度,使K成蒸气从反应混合物中分离出来
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
通过粮食发酵可获得某含氧有机化合物X,其相对分子质量为46,其中碳的质量分数为52.2%,氢的质量分数为13.0%。
(1)X的分子式是______________________。
(2) X与空气中的氧气在铜或银催化下反应生成Y,Y的结构式是________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
某研究性学习小组查阅资料知:O2在酸性环境中氧化性明显增强,为了探究过氧化钠的强氧化性,设计了如图的实验装置。实验步骤及现象如下:
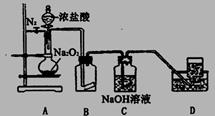
①检查装置气密性后,装入药品并连接仪器:
②缓慢通入一定量的N2后,将装置D连接好(导管末端未伸入集气瓶中),再向圆底烧瓶中缓慢滴加浓盐酸,剧烈反应,产生黄绿色气体。
③一段时间后,将导管末端伸入集气瓶中收集气体。装置D中收集到能使带火星的木条复燃的无色气体。
④反应结束后,关闭分液漏斗的活塞,再通入一定量N2,至装置中气体无色。回答下列问题:
(1)装置B中的湿润的红色纸条褪色,证明A中反应有__________(填化学式)生成。
若B中改放湿润的淀粉KI试纸,仅凭试纸变蓝的现象不能证明上述结论,请用离子方程式说明原因__________________________。
(2)装置C的作用是_________________________________。
(3)甲同学认为O2是Na2O2被盐酸中的HCl还原所得。乙同学认为此结论不正确,他可能的理由为①O2有可能是Na2O2与盐酸中的H2O反应所得:②___________________。
( 4)实验证明,Na2O2与干燥的HC1能反应,该反应_______________(填“能”或“不能”)用于实验室快速制取纯净的C12,理由是(要求从两个不同的方面答出要点)
4)实验证明,Na2O2与干燥的HC1能反应,该反应_______________(填“能”或“不能”)用于实验室快速制取纯净的C12,理由是(要求从两个不同的方面答出要点)
①_____________________;②_________________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
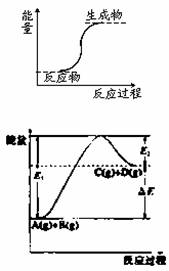
下列反应属于放热反应的是
A.能量变化如图所示的反应
B.燃烧反应和铝热反应
C.化学键断裂吸收的热量比化学键生成放出的热量多的反应
D.氢氧化钡晶体和氯化铵晶体的反应
查看答案和解析>>
科目:高中化学 来源: 题型:
反应2Z(g) X(g)+ Y(g),△H>0。达到平衡时,下列说法正确的是( )
X(g)+ Y(g),△H>0。达到平衡时,下列说法正确的是( )
A.加入催化剂,X的产率增大 B.升高温度,Y的转化率增大
C.当容器活塞可活动时,充入稀有气体,平衡不移动 D.充入Z气体时,Z的转化率增大
查看答案和解析>>
科目:高中化学 来源: 题型:
下图中a曲线表示一定条件下可逆反应
X(g)+Y(g)====2Z(g)+W(s) △H<0的反应过程。若使a曲线变为b曲线,可采用的措施是
A.升高温度 B.增大Y的浓度
C.降低温度 D.增大体系压强
查看答案和解析>>
科目:高中化学 来源: 题型:
⑴ 由氢气和氧气反应生成1mol水蒸气放热241.8kJ,写出该反应的热化学方程式: _ 。
若1g水蒸气转化成液态水放热2.444kJ,则氢气的燃烧热为_____________。
⑵已知① CO(g) + 1/2 O2(g) = CO2(g) ; ΔH1= -283.0 kJ/mol
② H2(g) + 1/2 O2(g) = H2O(l) ; ΔH2= -285.8 kJ/mol
③C2H5OH(l) + 3 O2(g) = 2 CO2(g) + 3H2O(l); ΔH3=-1370 kJ/mol
试写出一氧化碳与氢气反应生成液态水和乙醇液体的热化学方程式:
___________________________________________________________。
(3)Fe(s)+CO2(g) FeO(s)+CO(g) ΔH=a kJ·mol-1,平衡常数为K,测得在不同
FeO(s)+CO(g) ΔH=a kJ·mol-1,平衡常数为K,测得在不同
温度下,K值如下:
| 温度/℃ | 500 | 700 | 900 |
| K | 1.00 | 1.47 | 2.40 |
①若500℃时进行反应,CO2起始浓度为2 mol·L-1,CO的平衡浓度为________。
②此反应焓变中的a________0(填大于、小于、等于)。
查看答案和解析>>
科目:高中化学 来源: 题型:
有一化学反应:aA+bB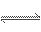 C,根据影响化学反应速率的因素可得v0=kcm(A)cn(B),其中k是与温度有关的常数,为测得k、m、n的值,在298 K时,将A、B溶液按不同浓度混合,得到下表中的实验数据:
C,根据影响化学反应速率的因素可得v0=kcm(A)cn(B),其中k是与温度有关的常数,为测得k、m、n的值,在298 K时,将A、B溶液按不同浓度混合,得到下表中的实验数据:
| 编号 | A的初 | B的初 | 生成C的 |
| 1 | 1.0 | 1.0 | 1.2×10-2 |
| 2 | 2.0 | 1.0 | 2.4×10-2 |
| 3 | 4.0 | 1.0 | 4.9×10-2 |
| 4 | 1.0 | 1.0 | 1.2×10-2 |
| 5 | 1.0 | 2.0 | 4.8×10-2 |
| 6 | 1.0 | 4.0 | 1.9×10-1 |
(1)依表中数据可求得m=___________,n=___________,k=___________,k的单位是___________。
(2)若a=m,b=n,当c(A)=c(B)=2.0 mol·L-1时,求以B表示的初始反应速率。
查看答案和解析>>
科目:高中化学 来源: 题型:
已知A(g)+B(g)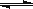 C(g)+D(g)反应的平衡常数和温度的关系如下:
C(g)+D(g)反应的平衡常数和温度的关系如下:
| |温度/℃ | 700 | 900 | 830 | 1000 | 1200 |
| 平衡常数 | 1.7 | 1.1 | 1.0 | 0.6 | 0.4 |
回答下列问题:
(1)该反应的平衡常数表达式K= ▲ ,△H ▲ 0(填“<”“ >”“ =”);
(2) 830℃时,向一个 5 L的密闭容器中充入0.20mol的A和0.80mol的B,如反应初始6s内A的平均反应速率v(A)=0.003mol·L-1·s-1。,则6s时c(A)= ▲ mol·L-1,C的物质的量为 ▲ mol;反应经一段时间后达到平衡,此时A的转化率为 ▲ ,如果这时向该密闭容器中再充入1 mol氩气,平衡时A的转化率为 ▲ ;
(3)判断该反应是否达到平衡的依据为 ▲ (填正确选项前的字母):
a.压强不随时间改变 b.气体的密度不随时间改变
c. c(A)不随时间改变 d.单位时间里生成C和A的物质的量相等
(4)1200℃时反应C(g)+D(g)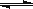 A(g)+B(g)的平衡常数的值为 ▲ 。
A(g)+B(g)的平衡常数的值为 ▲ 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com