
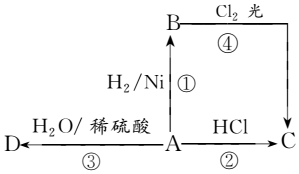
 某烃A是有机化学工业的基本原料,其产量可以用来衡量一个国家的石油化工发展水平,A还是一种植物生长调节剂,A可发生如图所示的一系列化学反应,其中①②③属于同种反应类型.根据图回答下列问题:
某烃A是有机化学工业的基本原料,其产量可以用来衡量一个国家的石油化工发展水平,A还是一种植物生长调节剂,A可发生如图所示的一系列化学反应,其中①②③属于同种反应类型.根据图回答下列问题:分析 烃A的产量可以用来衡量一个国家的石油化工发展水平,还是一种植物生长调节剂,故A为CH2=CH2,CH2=CH2与氢气发生加成反应生成B,B为CH3CH3,乙烯与HCl发生加成反应生成C,C为CH3CH2Cl,乙烯与水发生加成反应生成D,D为CH3CH2OH,以此来解答.
解答 解:(1)由上述分析可知,A、B、C、D分别为CH2=CH2、CH3CH3、CH3CH2Cl、CH3CH2OH,
故答案为:CH2═CH2;CH3CH3;CH3CH2Cl;CH3CH2OH;
(2)反应②为CH2=CH2+HCl$\stackrel{一定条件}{→}$CH3CH2Cl,属于加成反应,
反应④为CH3CH3+Cl2$\stackrel{光}{→}$CH3CH2Cl+HCl,属于取代反应,
故答案为:CH2=CH2+HCl$\stackrel{一定条件}{→}$CH3CH2Cl;加成反应;CH3CH3+Cl2$\stackrel{光}{→}$CH3CH2Cl+HCl;取代反应;
(3)A为CH2=CH2,含有的官能团为碳碳双键,故答案为:碳碳双键.
点评 本题考查有机物的推断,为高频考点,把握官能团与性质的关系、有机物的转化关系为解答的关键,侧重分析与推断能力的考查,注意A为乙烯是解答的突破口,题目难度不大.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②④ | B. | ②③⑥ | C. | ②⑤⑥ | D. | ④⑤⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 编号 | 起始温度T1/℃ | 终止温度T2/℃ | 平均温度差T2-T1/℃ | △H | ||
| 盐酸 | NaOH | 平均值 | ||||
| 1 | 26.2 | 26.0 | 26.1 | 29.2 | ------- | ------- |
| 2 | 25.9 | 25.9 | 25.9 | 29.2 | ||
| 3 | 26.4 | 26.2 | 26.3 | 29.5 | ||
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 锂-磷酸氧铜电池正极的活性物质是Cu4O(PO4)2,可通过下列反应制备:
锂-磷酸氧铜电池正极的活性物质是Cu4O(PO4)2,可通过下列反应制备: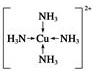 .
.查看答案和解析>>
科目:高中化学 来源: 题型:推断题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com