
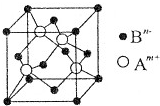
 A、B、C是中学化学中常见的三种元素(A、B、C代表元素符号).A位于元素周期表中第4周期,其基态原子最外层电子数为2且内层轨道全部排满电子.短周期元素B的一种常见单质为淡黄色粉末.元素C的原子最外层电子数是其内层电子数的3倍.
A、B、C是中学化学中常见的三种元素(A、B、C代表元素符号).A位于元素周期表中第4周期,其基态原子最外层电子数为2且内层轨道全部排满电子.短周期元素B的一种常见单质为淡黄色粉末.元素C的原子最外层电子数是其内层电子数的3倍.| 1 |
| 2 |
| 1 |
| 8 |
| 6-1×2 |
| 2 |
| 6+2-2×4 |
| 2 |


 能力评价系列答案
能力评价系列答案 唐印文化课时测评系列答案
唐印文化课时测评系列答案 导学与测试系列答案
导学与测试系列答案科目:高中化学 来源: 题型:
A、 检查气密性 |
B、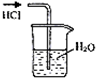 吸收HCl |
C、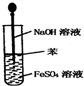 制取Fe(OH)2沉淀 |
D、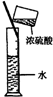 稀释浓H2SO4 |
查看答案和解析>>
科目:高中化学 来源: 题型:
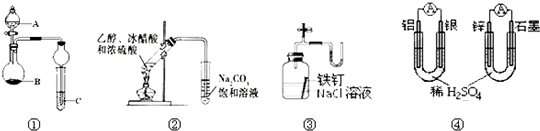
| A、图①中,若A为浓盐酸,B为MnO2,C中盛石蕊试液,则C中溶液先变红后褪色 |
| B、图②制备乙酸乙酯 |
| C、图③证明铁生锈与空气有关 |
| D、图④两个装置中通过导线的电子数相同时,消耗负极材料的物质的量也相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、在c(H+)=1.0×10-13mol?L-1的溶液中:Na+、S2-、AlO2-、SO32- |
| B、有NO3-存在的强酸性溶液中:NH4+、Ba2+、Fe2+、Br- |
| C、某无色透明溶液中:Na+、MnO4-、SO42-、CO32- |
| D、某溶液既能溶解Al(OH)3,又能溶解H2SiO3:K+、Na+、HCO3-、NO3- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com