
已知饱和酸(A)与足量的乙醇(B)在一定条件下生成酯(C),若M(C)=M(A)+56且A分子比B分子多3个碳原子,则上述反应生成的C最多有
A.4种 B.5种 C.6种 D.7种
科目:高中化学 来源:2016届浙江省宁波市高三上学期10月月考化学试卷(解析版) 题型:选择题
加碘食盐中含有碘酸钾(KIO3),现以电解法制备碘酸钾,实验装置如图所示。先将一定量的碘溶于过量氢氧化钾溶液,发生反应:3I2+6KOH=5KI+KIO3+3H2O,将该溶液加入阳极区,另将氢氧化钾溶液加入阴极区,开始电解。下列说法中正确的是
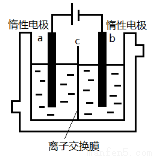
A.电解过程中OH-从a极区通过离子交换膜c进入b极区
B.随着电解进行,KOH溶液浓度会逐渐减小
C.当阳极有0.1mol I-放电时,阴极生成6.72LH2
D.a电极反应式:I- -6e-+6OH-=IO3-+3H2O,a极区的KI最终转变为KIO3
查看答案和解析>>
科目:高中化学 来源:2015-2016学年江苏省高一上期中测试化学试卷(解析版) 题型:选择题
下列反应的离子方程式书写正确的是
A.往澄清石灰水中通入过量的CO2:OH-+CO2=HCO3-
B.稀H2SO4与铁粉反应:2Fe+6H+=2Fe3+ + 3H2↑
C.钠和冷水反应:Na+2H2O=Na++2OH-+H2↑
D.小苏打与醋酸反应:HCO3-+2H+=H2O+CO2↑
查看答案和解析>>
科目:高中化学 来源:2016届福建省福州市高三上学期期中测试化学试卷(解析版) 题型:选择题
一定温度下,向饱和NaOH溶液中加入一定量的钠块,充分反应后恢复到原来温度,下列说法正确的是
A.溶液中溶质质量增加,溶剂质量减少,溶液中溶质的质量分数变大
B.溶液的pH不变,有氢气放出
C.溶液中的Na+数目减小,有氧气放出
D.溶液中的c(Na+)增大,有氢气放出
查看答案和解析>>
科目:高中化学 来源:2016届河南省林州市高三上学期9月质检化学试卷(解析版) 题型:填空题
(12分)氧元素性质活泼,在众多的含氧化合物中氧元素显-2价,但也能形成一定数量的显正价的化合物。
(1)OF2是一种棕黄色有恶臭的气体,有极强的氧化性。
①OF2中氧元素的化合价为 。
②将Fz通入稀的NaOH溶液中可得到OF2、盐等物质,相应反应的化学方程式为________________。
(2)过氧化氢是一种绿色氧化剂、还原剂,工业上有多种方法制备H2O2。
①研究表明,H2O2相当于二元弱酸,则它的一级电离方程式为 ,已知常温下1L的H2O2相当于48.3 mol,其K1≈1.67×10 -12.则该温度下H2O2中c(H+)约为 ,写出它与足量Ba(OH)2反应的化学方程式为 。
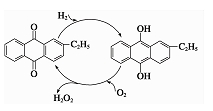
②乙基蒽醌法是制备过氧化氢最常用的方法,其主要过程可以用右图表示,写出此过程的总反应方程式
③空气阴极法制备H2O2是一种环境友好型、节能型制备方法,电解总方程式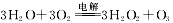 ,则阳极上电极反应式为 。
,则阳极上电极反应式为 。
(3)氧也能与钾元素形成K2O、K2O2、KO2、KO3等氧化物,其中KO2是一种比Na2O2效率高的供氧剂,写出它与CO2反应的化学方程式 。
查看答案和解析>>
科目:高中化学 来源:2016届四川省成都市高三上学期期中考试理综化学试卷(解析版) 题型:填空题
(本小题满分15分)
参考下列图表和有关要求回答问题:
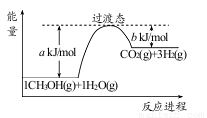
(1)甲醇质子交换膜燃料电池中将甲醇蒸气转化为氢气的一种原理是CH3OH(g)和H2O(g)反应生成CO2和H2。右图是该过程中能量变化示意图,若在反应体系中加入催化剂,反应速率增大,正反应活化能 a的变化是_____________(填“增大”、“减小”、“不变”),反应热△H的变化是_____________(填“增大”、“减小”、“不变”)。请写反应进程出CH3OH(g)和H2O(g)反应的热化学方程式_____________。
(2)甲醇质子交换膜燃料电池中将甲醇蒸气转化为氢气的另一种反应原理是:CH3OH(g)+1/2O2(g) 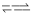 CO2(g)+2H2(g) △H=c kJ/mol又知H2O(g)
CO2(g)+2H2(g) △H=c kJ/mol又知H2O(g) 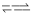 H2O(l) △H=d kJ/mol。则甲醇燃烧生成液态水的热化学方程式为_____________。
H2O(l) △H=d kJ/mol。则甲醇燃烧生成液态水的热化学方程式为_____________。
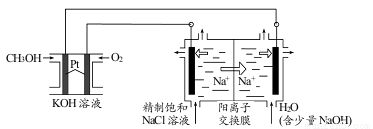
(3)以CH3OH燃料电池为电源电解法制取ClO2。二氧化氯(ClO2)为一种黄绿色气体,是国际上公认的高效、广谱、快速、安全的杀菌消毒剂。
①CH3OH燃料电池放电过程中,通入 O2的电极附近溶液的pH_____________,负极反应式为_____________。
②图中电解池用石墨作电极,在一定条件下电解饱和食盐水制取 ClO2。阳极产生 ClO2的反应式为_____________。
③电解一段时间,从阴极处收集到的气体比阳极处收集到气体多 6.72L时(标准状况,忽略生成的气体溶解),停止电解,通过阳离子交换膜的阳离子为_____________mol。
查看答案和解析>>
科目:高中化学 来源:2016届西藏拉萨中学高三上学期第二次月考化学试卷(解析版) 题型:填空题
(14分)甲醇是重要的化工原料,又可作为燃料。利用合成气(主要成分为CO、CO2和H2)在催化剂的作用下合成甲醇,发生的主反应如下:
① CO(g) + 2H2(g) CH3OH(g) △H1
CH3OH(g) △H1
② CO2(g) + 3H2(g) CH3OH(g)+ H2O(g) △H2
CH3OH(g)+ H2O(g) △H2
③ CO2(g) + H2(g) CO(g) + H2O(g) △H3
CO(g) + H2O(g) △H3
回答下列问题:
(1)已知
化学键 | H-H | C-O | C=O | H-O | C-H |
E/(kJ.mol-1) | 436 | 343 | 1076 | 465 | 413 |
则△H1= kJ.mol-1
(2)图1中能正确表现反应①的平衡常数K随温度变化关系的曲线为 (填曲线标记字母),判断理由是 。

(3)合成气的组成n(H2)/n(CO+CO2)=2.60时体系中的CO平衡转化率(α)与温度和压强的关系如图2所示。α(CO)值随温度升高而 (填“增大”或“减小”)原因是 。
图2中的压强由大到小为 ,判断理由是 。
查看答案和解析>>
科目:高中化学 来源:2015-2016学年河北省高二上学期10月月考化学试卷(解析版) 题型:填空题
工业上合成氨是在一定条件下进行如下反应:
N2(g)+3H2(g) 2NH3(g),△H=﹣92.44kJ/mol;回答下列问题:
2NH3(g),△H=﹣92.44kJ/mol;回答下列问题:
①写出该反应的化学平衡常数表达式:K= .随着温度的升高,K值 。(填增大、减小、不变).
②平衡常数K值越大,表明 (填序号).
A.N2的转化率越高 B.NH3的产率越大
C.原料中N2的含量越高 D.化学反应速率越快
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com