
| A. | CuSO4 | B. | NaOH | C. | AgNO3 | D. | NaCl |
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:选择题
| A. | 利用甲苯的硝化反应可以制得TNT炸药 | |
| B. | 苯与甲苯互为同系物,可以用KMnO4酸性溶液进行鉴别 | |
| C. | 苯和溴水振荡后,由于发生化学反应而使溴水的水层颜色变浅 | |
| D. | 煤焦油中含有苯和甲苯,用蒸馏的方法把它们分离出来 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
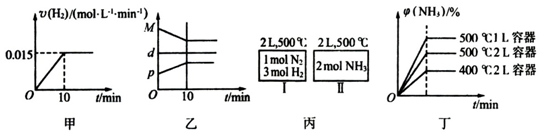
| A. | 若达到平衡时,测得体系放出9.24kJ热量,则H2反应速率变化曲线如图甲所示 | |
| B. | 反应过程中,混合气体平均相对分子质量为M,混合气体密度为d,混合气体压强为p,三者关系如图乙 | |
| C. | 如图丙所示,容器I和II达到平衡时,NH3的体积分数为φ,则容器I放出热量与容器II吸收热量之和为92.4kJ | |
| D. | 若起始加入物料为1 mol N2,3 mol H2,在不同条件下达到平衡时,NH3的体积分数变化如图丁所示 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | V(SO2)=4mol•L-1•min-1 | B. | V(O2)=3mol•L-1•min-1 | ||
| C. | V(SO3)=0.1mol•L-1•S-1 | D. | V(O2)=0.1mol•L-1•S-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
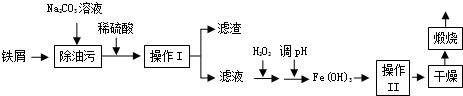
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
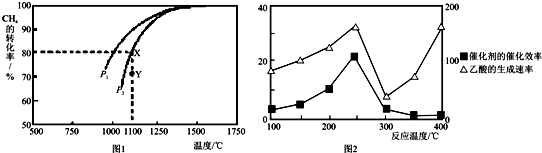
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
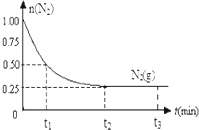 一定温度下,在体积为2L的恒容密闭容器中充入1mol N2和3mol H2,一定条件下发生反应:N2(g)+3H2(g)?2NH3(g),测得其中N2(g)物质的量随时间变化如图.
一定温度下,在体积为2L的恒容密闭容器中充入1mol N2和3mol H2,一定条件下发生反应:N2(g)+3H2(g)?2NH3(g),测得其中N2(g)物质的量随时间变化如图.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com