
| A. | Na2CO3溶液 | B. | BaCl2溶液 | C. | Ba(OH)2溶液 | D. | Fe(OH)3胶体 |
分析 先判断硫酸与各选项物质是否发生反应,若反应是否有白色沉淀生成,再判断白色沉淀是否溶于硫酸,以此解答该题.
解答 解:A、Na2CO3与H2SO4反应生成二氧化碳气体,没有沉淀生成,故A错误;
B、BaCl2与H2SO4反应:BaCl2+H2SO4=BaSO4↓+2HCl,生成BaSO4白色沉淀,不溶于硫酸,继续滴加稀硫酸,沉淀不溶解,故B错误;
C、硫酸与氢氧化钡反应生成硫酸钡沉淀,继续加入硫酸,沉淀不溶解,故C错误;
D、Fe(OH)3胶体中加入硫酸溶液,开始胶体发生聚沉,当硫酸较多时会与氢氧化铁沉淀发生中和反应,沉淀又溶解,故D正确;
故选D.
点评 本题综合考查元素化合物知识,为高考常见题型和高频考点,侧重于学生的分析能力的考查,题目考查物质之间的反应,注意现象是反应的体现,关键是清楚物质的性质及物质间的反应,注重基础知识的积累,题目难度不大.


科目:高中化学 来源: 题型:解答题
 请回答下列问题:
请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
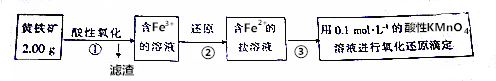
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2个 | B. | 3个 | C. | 4个 | D. | 5个 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
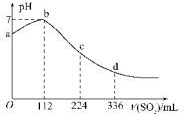 标准状况下,某同学向100mLH2S饱和溶液中通入SO2,所得溶液pH变化如图所示,下列分析中,正确的是( )
标准状况下,某同学向100mLH2S饱和溶液中通入SO2,所得溶液pH变化如图所示,下列分析中,正确的是( )| A. | 亚硫酸是比氢硫酸更弱的酸 | |
| B. | ab段反应是:SO2+2H2S═3S↓+2H2O | |
| C. | 原H2S溶液的物质的量浓度为0.05 mol/L | |
| D. | b点对应的溶液导电性最强 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1.4g | B. | 2.8g | C. | 5.6g | D. | 11.2g |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com