
【题目】下列有机化合物中均含有酸性杂质,除去这些杂质的方法中正确的是( )
A. 乙酸丁酯中含乙酸杂质:加入饱和碳酸钠溶液洗涤,分液
B. 乙醇中含乙酸杂质:加入碳酸钠溶液洗涤,分液
C. 乙醛中含乙酸杂质:加入氢氧化钠溶液洗涤,分液
D. 苯中含苯酚杂质:加入溴水,过滤
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】镓(Ga)被誉为第三代半导体的明屋元素,广泛应用于电子工业。Ga位于周期表的第四周期,与A1同主族,主要存在Ga3+、GaO2-两种离子形态。
(1)请画出Ga的原子结构示意图___________。
(2)请写出Ga2O3溶解在NaOH溶液中的离子方程式_________________。
(3)氮化镓(GaN)可用于制作蓝色LED光源。GaN的传统工艺是用GaCl3与NH3反应来制备,新工艺则采用金属Ga与NH3在一定条件下来合成。已知:
①GaCl3(s)+NH3(g)=GaN(s)+3HCl(g) H1=+180kJ/mol
②2Ga(s)+6HCl(g)=2GaCl3(s)+3H2(g)H2=-492kJ/mol
③Ga(s)+NH3(g)=GaN(s)+3/2H2(g) H3
由上述反应可知H3=_____________。

已知H-H的键能为436kJ/mol,结合上图分析,1molGaN含有_____molGa-N键,拆开lmolGa-N键所需能量为______kJ。
(4)工业上多用电解精炼法提纯镓。具体原理如下图所示:

已知:金属的活动性Zn>Ga>Fe>Cu
①A为电源的_____极,电解精炼镓时产生阳极泥的主要成分是___________。
②电解过程中阳极产生的离子迁移到达阴极并在阴极放电析出高纯镓。请写出电解过程的阴极的电极反应_______________。
③电解过程中需控制合适的电压,若电压太高时阴极会产生H2导致电解效率下降。若外电路通过0.4mole-时,阴极得到7.0g的镓。则该电解装置的电解效率η=___________。(η=生成目标产物消耗的电子数÷转移的电子总数)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】保护环境已成为当前和未来的全球性的重大课题之一,下列因为人类生产对环境破坏而带来的后果是( )
①土地沙漠化 ②酸雨 ③水资源危机 ④南极上抽样空洞 ⑤沙尘暴.
A.①②⑤
B.①②④⑤
C.②⑤
D.①②③④⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钾长石(K2Al2Si6O16)通常也称正长石,主要用于生产玻璃、陶瓷制品,还可用于制取钾肥。某学习小组以钾长石为主要原料,从中提取氧化铝、碳酸钾等物质,工艺流程如下:
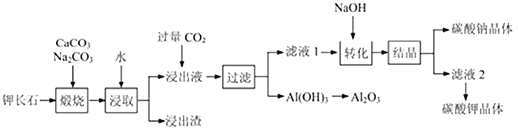
回答以下问题:
(1)请以氧化物组成的形式表示钾长石的化学式为_____________
(2)煅烧过程后,钾长石中的硅元素以______________(填化学式)的形式存在于浸出渣中;已知钾元素和铝元素在Na2CO3作用下转化为可溶性的KAlO2和NaAlO2,写出Al2O3与Na2CO3反应生成NaAlO2 的化学方程式______________________________。
(3)“浸取”过程中,需要将钾长石由块状固体粉碎为较小颗粒,其目的是___________
(4)“转化”时加入NaOH溶液的作用是_________________________ (用离子方程式表示)
(5)此工艺中可以循环利用的主要物质是___________、___________和水。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】盐酸艾司洛尔,主要用于急性心肌局部缺血症的治疗,对急性心肌梗塞有明显的疗效。其合成新路线如下: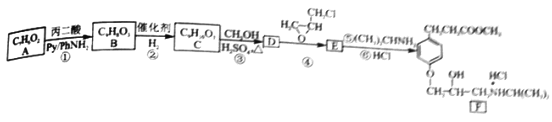
已知:①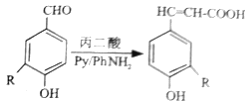
②
(1)A的名称是______,B 含有的官能团是______,②的反应类型是_______。
(2)写出反应③的化学方程式___________。
(3)E 的结构简式为___________。
(4)F物质可溶于水,原因是__________。
(5)与B 具有相同的官能团且苯环上有三侧链的同分异构体,其总数目为______。
(6)参照E 物质的合成路线,以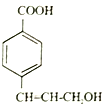 和
和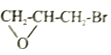 为主要原料合成制备
为主要原料合成制备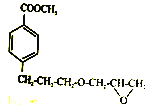 ,写出其合成路线_________。
,写出其合成路线_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中,正确的是( )
A.石油裂化的目的是获得更多的乙烯,丙烯等原料
B.石油分馏,煤的干馏发生的都是物理变化
C.油脂的皂化发生的是化学变化
D.向蛋白质溶液中分别加入硫酸铜,硫酸铵的浓溶液都可以发生盐析
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E代表原子序数依次增大的前四周期元素,其中A和C为同一主族,C常用于制作半导体器件和集成电路,B的简单氢化物的水溶液呈碱性,E元素的正三价离子的3d亚层为半充满,D被称为“未来金属”,其重量轻、强度高、耐腐蚀,其在周期表中位于第4周期、第ⅣB族。
(1)A、B、C三种元素的第一电离能由小到大的顺序为______________________,电负性由小到大的顺序为____________________。
(2)B的简单氢化物易液化的原因是_______________;BH4+中B原子的杂化方式为___________,空间构型为__________________。
(3)E元素基态原子的电子排布式为____________________________________。
(4)B和C形成的化合物常用作高温耐火材料,化学性质稳定,据此推测它应属于__________________晶体。
(5)D有多种氧化物,其中一种氧化物的晶胞结构如图1所示,则该晶体中D的配位数为__________________;图2为E的一种面心立方晶胞结构,若晶胞的边长为acm,NA表示阿伏加德罗常数的值,则E的密度为__________________g·cm-3(用含a和NA的代数式表示)。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知在稀溶液中,酸跟碱发生中和反应生成1 mol水时的反应热叫做中和热。现利用如图装置进行中和热的测定,请回答下列问题:
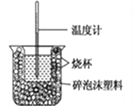
(1)图示装置有两处重要组成部分未画出,它们是____________ 、_______________。
(2)烧杯间填满碎泡沫塑料的作用是 ________________。
(3)若操作时分几次注入反应液,求得的反应热数值_____(填“偏大”“偏小”或“无影响”)。
(4)做一次完整的中和热测定实验,温度计需使用__________次。
(5)量取0.5 mol/L的盐酸和0.55 mol/L的NaOH溶液各50 mL进行实验,测得盐酸和NaOH溶液起始平均温度为t1℃,混合反应后最高温度为t2℃,设溶液密度均为1 g/mL,生成溶液的比热容c= 4.18 J/(g℃)。请列式计算中和热:△H= ______________kJ/mol(不用化简)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com