
下列反应离子方程式正确的是( )
|
| A. | 过量石灰水与碳酸氢钙反应:Ca2++2HCO3﹣+2OH﹣═CaCO3↓+CO32﹣+2H2O |
|
| B. | FeSO4酸性溶液暴露在空气中:4Fe2++O2+4H+═4Fe3++2H2O |
|
| C. | 向氯化铝溶液中滴加过量氨水:Al3++4NH3•H2O═AlO42﹣+4NH4++2H2O |
|
| D. | H2SO4与Ba(OH)2溶液反应:Ba2++OH﹣+H++SO42﹣═BaSO4↓+H2O |
| 离子方程式的书写. | |
| 专题: | 离子反应专题. |
| 分析: | A.反应生成碳酸钙和水; B.发生氧化还原反应,遵循电子、电荷守恒及原子守恒; C.反应生成氢氧化铝和氯化铵; D.不符合离子的配比. |
| 解答: | 解:A.过量石灰水与碳酸氢钙反应的离子反应为Ca2++HCO3﹣+OH﹣═CaCO3↓+H2O,故A错误; B.FeSO4酸性溶液暴露在空气中的离子反应为4Fe2++O2+4H+═4Fe3++2H2O,故B正确; C.向氯化铝溶液中滴加过量氨水的离子反应为Al3++3NH3•H2O═Al(OH)3↓+3NH4+,故C错误; D.H2SO4与Ba(OH)2溶液反应的离子反应为Ba2++2OH﹣+2H++SO42﹣═BaSO4↓+2H2O,故D错误; 故选B. |
| 点评: | 本题考查离子反应书写的正误判断,为高频考点,把握发生的化学反应及离子反应的书写方法为解答的关键,侧重氧化还原反应及复分解反应的离子反应考查,注意离子反应中保留化学式的物质,题目难度不大. |


 字词句篇与同步作文达标系列答案
字词句篇与同步作文达标系列答案科目:高中化学 来源: 题型:
元素周期律产生的根本原因就是随着元素原子序数的递增
A.元素的相对原子质量逐渐增大
B.核外电子排布呈周期性变化
C.原子半径呈周期性变化
D.元素主要化合价呈周期性变化
查看答案和解析>>
科目:高中化学 来源: 题型:
焦亚硫酸钠(Na2S2O5)是常用的食品抗氧化剂之一。某研究小组进行如下实验:
实验一 焦亚硫酸钠的制取
采用下图装置(实验前已除尽装置内的空气)制取Na2S2O5。装置Ⅱ中有Na2S2O5晶体析出,发生的反应为Na2SO3+SO2===Na2S2O5。
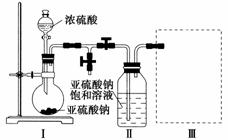
(1)装置Ⅰ中产生气体的化学方程式为________________________。
(2)要从装置Ⅱ中获得已析出的晶体,可采取的分离方法是________________________。
(3)装置Ⅲ用于处理尾气,可选用的最合理装置(夹持仪器已略去)为________(填序号)。
实验二 焦亚硫酸钠的性质
Na2S2O5溶于水即生成NaHSO3。
(4)证明NaHSO3溶液中HSO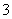 的电离程度大于水解程度,可采用的实验方法是 ________ (填序号)。
的电离程度大于水解程度,可采用的实验方法是 ________ (填序号)。
a.测定溶液的pH
b.加入Ba(OH)2溶液
c.加入盐酸
d.加入品红溶液
e.用蓝色石蕊试纸检测
(5)检验Na2S2O5晶体在空气中已被氧化的实验方案是________________________。
实验三 葡萄酒中抗氧化剂残留量的测定
(6)葡萄酒常用Na2S2O5作抗氧化剂。测定某葡萄酒中抗氧化剂的残留量(以游离SO2计算)的方案如下:
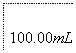

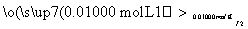 溶液出现蓝色且30 s内不褪色
溶液出现蓝色且30 s内不褪色
(已知:滴定时反应的化学方程式为SO2+I2+2H2O===H2SO4+2HI)
①按上述方案实验,消耗标准I2溶液25.00 mL,该次实验测得样品中抗氧化剂的残留量(以游离SO2计算)为________g·L-1。
②在上述实验过程中,若有部分HI被空气氧化,则测定结果________(填“偏高”“偏低”或“不变”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
某研究小组为了探究一种无机矿物盐X(仅含四种元素)的组成和性质,设计并完成了如下实验:

另取10.80 g X在惰性气流中加热至完全分解,得到6.40 g固体1。
请回答如下问题:
(1)画出白色沉淀1中金属元素的原子结构示意图________,写出气体甲的电子式________。
(2)X的化学式是________,在惰性气流中加热X至完全分解的化学反应方程式为____________________。
(3)白色沉淀2在空气中变成红褐色沉淀的原因是____________________(用化学反应方程式表示)。
(4)一定条件下,气体甲与固体1中的某种成分可能发生氧化还原反应,写出一个可能的化学反应方程式____________________,并设计实验方案验证该反应的产物____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列实验能够成功的是( )
|
| A. | 只用溴水一种试剂可鉴别甲苯、己烯、乙醇、四氯化碳四种液体 |
|
| B. | 用苯和溴水在Fe催化下可制的溴苯 |
|
| C. | 用乙醇、冰醋酸和pH=1的H2SO4溶液混合加热可制备乙酸乙酯 |
|
| D. | 用酚酞可鉴别苯酚钠和乙酸钠两种溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:
有机物的结构简式如图所示,则此有机物可发生的反应类型有( )
①取代 ②加成 ③消去 ④酯化 ⑤水解 ⑥氧化 ⑦中和.
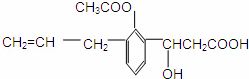
|
| A. | ①②③⑤⑥ | B. | ①②③④⑤⑥⑦ | C. | ②③④⑤⑥ | D. | ②③④⑤⑥⑦ |
查看答案和解析>>
科目:高中化学 来源: 题型:
根据下图海水综合利用的工业流程图,判断下列说法正确的是( )

已知:MgCl2•6H2O受热生成Mg(OH)Cl和HCl气体等.
|
| A. | 氯碱工业中电解饱和食盐水是一个将化学能转化为电能的过程 |
|
| B. | 在过程③中将MgCl2•6H2O灼烧即可制得无水MgCl2 |
|
| C. | 在过程④、⑥反应中每氧化0.2 mol Br﹣ 需消耗0.1mol Cl2 |
|
| D. | 过程⑤在生产中无需解决其对金属设备的腐蚀问题 |
查看答案和解析>>
科目:高中化学 来源: 题型:
乙醇、乙二醇、丙三醇分别与足量的金属钠作用,产生等量的氢气,则三种醇的物质的量之比为( )
A.6∶3∶2 B.1∶2∶3 C.3∶2∶1 D.4∶3∶2
查看答案和解析>>
科目:高中化学 来源: 题型:
下图是以石油为原料的部分转化流程:
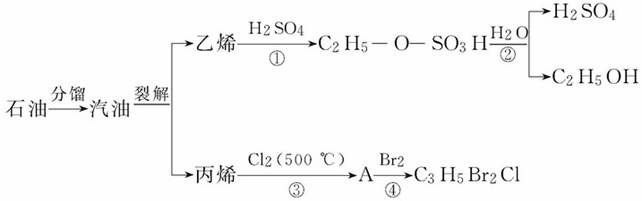
下列关于四个反应的反应类型的说法正确的是( )
A.反应①与反应③反应类型相同
B.反应①与反应④反应类型相同
C.反应③与反应④反应类型相同
D.反应②与反应④反应类型相同
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com