
分析 I.一氧化碳在高温下可与氧化铁发生反应生成铁和二氧化碳,铁元素由+3价变为0价,碳由+2价变为+4价,根据化合价变化的数值判断电子转移的数目,根据电子转移的数目计算生成的气体的体积,根据V=n•Vm计算气体的体积;
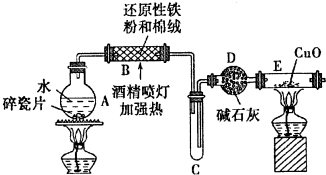
Ⅱ.由图可知,A中加热提供水蒸气,在B中发生Fe与水蒸气的反应生成四氧化三铁和氢气,C为缓冲装置,D中干燥管干燥氢气,E为氢气还原氧化铜的装置,以此来解答.
(1)根据铁在高温下与水反应生成四氧化三铁和氢气;
(2)碱石灰的作用是干燥氢气,A中加热提供水蒸气,投放碎瓷片的目的是防止暴沸;
(3)E为氢气还原氧化铜的装置,B、E两处酒精灯,必须后点燃的是E,需B制取氢气;
(4)装置E为氢气还原氧化铜的装置,氧化铜为黑色,铜为光亮的红色;
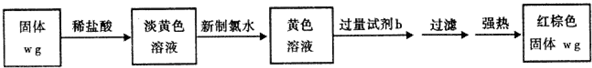
Ⅲ.由“红棕色固体”知,该物质为Fe2O3,反应转化关系为:Fe→FeCl2$\stackrel{Cl_{2}}{→}$FeCl3→Fe(OH)3,则试剂b为NaOH溶液.
(1)加入新制氯水,氯气氧化亚铁离子;
(2)根据铁元素守恒计算,氧化铁中铁元素的质量分数等于硬质玻璃管B中固体含铁元素的质量分数.
解答 解:I.一氧化碳在高温下可与氧化铁发生反应:Fe2O3+3CO$\frac{\underline{\;高温\;}}{\;}$2Fe+3CO2,铁元素由+3价变为0价,1molFe2O3发生反应时,得电子6mol,1molFe2O3发生反应,生成CO2气体3mol,在标准状况下的体积V=n•Vm=3mol×22.4mol/L=67.2L,
故答案为:6;67.2;
Ⅱ.(1)铁在高温下与水反应生成四氧化三铁和氢气,反应方程式为:3Fe+4H2O(g)$\frac{\underline{\;高温\;}}{\;}$Fe3O4+4H2,
故答案为:3Fe+4H2O(g)$\frac{\underline{\;高温\;}}{\;}$Fe3O4+4H2;
(2)D中药品为碱石灰,碱石灰主要是氧化钙和氢氧化钠的混合物,主要作为干燥剂,在该实验中可干燥氢气,A中加热提供水蒸气,投放碎瓷片的目的是防止暴沸,
故答案为:干燥氢气;防止暴沸;
(3)E为氢气还原氧化铜的装置,需B制取氢气;B为铁和水蒸气制取氢气,所以,必须后点燃的是E,
故答案为:E;
(4)氧化铜为黑色,装置E中氢气还原氧化铜,反应为:CuO+H2$\frac{\underline{\;\;△\;\;}}{\;}$Cu+H2O,现象为:黑色固体变红,右端管壁有水珠,
故答案为:黑色固体变红,右端管壁有水珠;
III.(1)氯气具有氧化性,能氧化亚铁离子,反应为:2Fe2++Cl2=2Fe3++2Cl-,
故答案为:2Fe2++Cl2=2Fe3++2Cl-;
(2)氧化铁的质量等于样品的质量,所以硬质玻璃管B中固体含铁元素的质量分数为氧化铁中铁的质量分数,则反应后B装置中铁元素的质量分数为:$\frac{2×56}{2×56+3×16}$×100%=70%,
故答案为:70%.
点评 本题考查性质实验的设计,为高频考点,把握发生的反应及装置的作用为解答关键,侧重分析与实验能力的考查,充分考查学生的分析、理解能力及化学实验、进行计算能力,题目难度中等.


 习题精选系列答案
习题精选系列答案科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 当△H为“-”时,表示该反应为吸热反应 | |
| B. | 化学反应的反应热只与反应体系的始态和终态有关,而与反应的途径无关 | |
| C. | H2S的燃烧热△H=-a kJ•mol-1,则表示H2S燃烧热的热化学方程式为2H2S(g)+3O2(g)═2SO2(g)+2H2O(l)△H=-2a kJ•mol-1 | |
| D. | 反应热的大小与反应物所具有的能量和生成物所具有的能量无关 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在上述两个反应中,当有1molP参加反应时,反应转移电子数均为5NA | |
| B. | 在反应(2)中,当生成3mol硫酸时,被还原的P为1mol | |
| C. | 在上述两个反应中,P均作还原剂 | |
| D. | 在上述两个反应中,还原产物都是H3PO4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
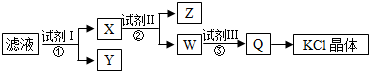
| A. | 图示的步骤中必需要经过2次过滤操作 | |
| B. | 起始滤液呈中性 | |
| C. | 试剂Ⅱ为Na2CO3溶液 | |
| D. | 试剂Ⅲ为盐酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
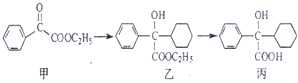
| A. | 化合物甲中的含氧官能团有 羰基和酯基 | |
| B. | 化合物乙与NaOH水溶液在加热条件下反应可生成化合物丙 | |
| C. | 化合物乙中含有1个手性碳原子 | |
| D. | 在NaOH醇溶液中加热,化合物丙可发生消去反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 等PH的氨水、KOH溶液、Ba(OH)2溶液中:c(NH4+)=c(K+)=c(Ba2+) | |
| B. | 等体积、等物质的量浓度的NaCl和NaClO溶液中离子总数(N):N(NaCl)<N(NaClO) | |
| C. | 将10mol0.1mol•L-1Na2CO3溶液逐渐滴加到10mL0.1mol•L-1盐酸中:c(Na+)>c(Cl-)>c(HCO3-)>c(CO32-) | |
| D. | 室温下,向0.1mol•L-1的醋酸钠溶液中通入氯化氢气体,使溶液的pH=7:>c(CH3COOH)=c(Cl-) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com