
T℃时,某一气态平衡体系中含有X(g)、Y(g)、Z(g)、W(g)四种物质,此温度下发生反应的平衡常数表达式为: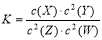 ,有关该平衡体系的说法正确的是
,有关该平衡体系的说法正确的是
A.该反应可表示为X(g) + 2Y(g) 2Z(g) + 2W(g)
2Z(g) + 2W(g)
B.减小X浓度,平衡向逆反应方向移动,平衡常数K减小
C.增大反应容器的压强,该反应速率一定增大
D.升高温度,W(g)体积分数增加,则正反应是放热反应
D
【解析】
试题分析:A.由于化学平衡常数是可逆反应达到平衡状态时各生成物浓度幂指数的乘积与各反应物浓度幂指数乘积的比。所以该反应可表示为2Z(g) + 2W(g)  X(g) + 2Y(g)。错误。B. 减小X浓度,平衡向正反应方向移动,但是由于反应的温度不变,所以化学平衡常数K不变。错误。C.若容器的容积不变,向容器内冲入与体系无关的气体而增大反应容器的压强,由于各物质的浓度没变,所以该反应速率不变;若缩小容器的容积,使物质的浓度增大,则化学反应速率加快。错误。D.根据平衡移动原理:升高温度,化学平衡向吸热反应方向移动。由于W(g)体积分数增加,则升高温度平衡逆向移动逆反应为吸热反应。则正反应是放热反应。正确。
X(g) + 2Y(g)。错误。B. 减小X浓度,平衡向正反应方向移动,但是由于反应的温度不变,所以化学平衡常数K不变。错误。C.若容器的容积不变,向容器内冲入与体系无关的气体而增大反应容器的压强,由于各物质的浓度没变,所以该反应速率不变;若缩小容器的容积,使物质的浓度增大,则化学反应速率加快。错误。D.根据平衡移动原理:升高温度,化学平衡向吸热反应方向移动。由于W(g)体积分数增加,则升高温度平衡逆向移动逆反应为吸热反应。则正反应是放热反应。正确。
考点:考查化学平衡常数的含义及浓度、温度、压强对化学平衡的影响的知识。


科目:高中化学 来源:2013-2014学年山东省枣庄市高三下学期第二次模拟考试理综化学试卷(解析版) 题型:实验题
工业上为了测定辉铜矿(主要成分是Cu2S)中Cu2S的质量分数,设计了如图装置。实验时按如下步骤操作:
A. 连接全部仪器,使其成为如图装置,并检查装置的气密性。
B. 称取研细的辉铜矿样品1.000g。
C. 将称量好的样品小心地放入硬质玻璃管中。
D. 以每分钟1L的速率鼓入空气。
E.将硬质玻璃管中的辉铜矿样品加热到一定温度,发生反应为:Cu2S+O2=SO2 +2Cu。
F. 移取25.00ml含SO2的水溶液于250ml锥形瓶中,用0.0100mol/L KMnO4标准溶液滴定至终点。按上述操作方法重复滴定2—3次。
试回答下列问题:
(1)装置①的作用是_________________;装置②的作用是____________________。
(2)假定辉铜矿中的硫全部转化为SO2,并且全部被水吸收,则操作F中所发生反应的化学方程式为 ,当产生______________________________ _的现象时可判断滴定已经达到终点。
(3)若操作F的滴定结果如下表所示,则辉铜矿样品中Cu2S的质量分数是_________。
滴定 次数 | 待测溶液的 体积/mL | 标准溶液的体积 | |
滴定前刻度/mL | 滴定后刻度/mL | ||
1 | 25.00 | 1.04 | 21.03 |
2 | 25.00 | 1.98 | 21.99 |
3 | 25.00 | 3.20 | 21.24 |
(4)本方案设计中由一个明显的缺陷影响了测定结果(不属于操作失误),你认为是 (写一种既可)。
(5)已知在常温下FeS 的 Ksp= 6 . 25 × 10 -18, H2S 饱和溶液中 c (H+)与 c (S2-)之间存在如下关系: c2 (H+) ·c(S2-) = 1 . 0×10-22 。在该温度下,将适量 FeS 投入硫化氢饱和溶液中,欲使溶液中c(Fe2+)为 lmol/L,应调节溶液的c(H十)为__________。
查看答案和解析>>
科目:高中化学 来源:2013-2014学年天津市高三年级4月考理综化学试卷(解析版) 题型:选择题
NA为阿伏伽德罗常数的值,下列叙述正确的是
A.由D和18O所组成的水11g,所含的中子数为4NA
B.常温常压下,8gO2含有4 NA个电子
C.25℃时,pH=13的1LBa(OH)2溶液中含有OH—的数目为0.2 NA
D.1L1mol/L的NaAlO2水溶液中含有的氧原子数为2NA
查看答案和解析>>
科目:高中化学 来源:2013-2014学年北京顺义区高三第二次统练理综化学试卷(解析版) 题型:选择题
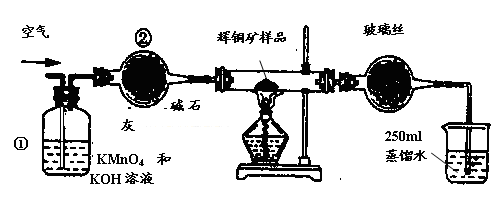
实验室中某些气体的制取、除杂及收集装置如图所示。仅用此装置和表中提供的物质完成相关实验,最合理的是
选项 | a中物质 | b中物质 | c中物质 | d中收集的气体 |
A | 浓氨水 | CaO | 浓H2SO4 | NH3 |
B | 浓硫酸 | Na2SO3 | 浓H2SO4 | SO2 |
C | 饱和食盐水 | 电石 | CuSO4溶液 | CH≡CH |
D | 浓盐酸 | MnO2 | 饱和NaCl溶液 | Cl2 |
查看答案和解析>>
科目:高中化学 来源:2013-2014学年北京市通州区高三年级模拟考试(一)理综化学试卷(解析版) 题型:填空题
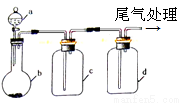
碱式氯化铝[ Al2(OH)nCl6-n ] 是利用工业铝灰和活性铝矾土为原料(主要含Al、Al2O3、SiO2及铁的氧化物)经过精制加工而成,此产品活性较高,对工业污水具有较好的净化效果。其制备流程如下:
(1)原料需要粉碎,其目的是 ;滤渣I的主要成分是 ;
(2)步骤①在煮沸过程中,溶液逐渐变为浅绿色,此时溶液中呈浅绿色的阳离子常采用加入 试剂进行检验(填化学式);随后溶液又变为棕黄色,相关反应的离子方程式为 ;
(3)步骤②中加入适量的Ca(OH)2并控制pH,其目的:一是生成碱式氯化铝;二是 ;已知碱式氯化铝的分散质粒子大小在1~100 nm之间,则区别滤液I与碱式氯化铝两种液体的物理方法是 ;若Ca(OH)2溶液过量,则步骤③得到的碱式氯化铝产率偏低,该反应的离子方程式为 ;
(4)某温度下若0.1 mol AlCl3溶于蒸馏水,当有2.5%水解生成Al(OH)3溶液时,吸收热量Q kJ ,该过程的热化学反应方程式为 。
查看答案和解析>>
科目:高中化学 来源:2013-2014学年北京市房山区高三一模理综化学试卷(解析版) 题型:填空题
某化学小组用下图装置电解CuCl2溶液制少量漂白液:
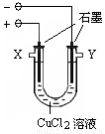
(1)其阳极的反应式是: ;导气管W端应与出气口 连接。
(2)实验后发现阴极碳棒上除了附着有红色物质,还附着有少量白色物质。
查阅资料显示:
物质名称及化学式 | 氯化亚铜CuCl | 碱式氯化铜Cu2( OH)3Cl |
性质 | 白色固体、不溶水 | 绿色固体、不溶水 |
化学小组分析提出:①红色物质可能有 、或Cu2O、或二者都有;②白色物质为CuCl
(3)为探究阴极碳棒上附着的红色、白色物质,设计了如下实验:
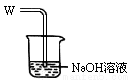
取出阴极碳棒,洗涤、干燥、称其质量为W1g ,并将其放入下图所示装置b中,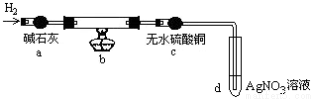
进行实验。实验中,碳棒上的白色物质完全变为红色,无水硫酸铜不变色,d中出现白色沉淀;实验结束时,继续通H2直至碳棒冷却后,称量其质量为W2g 。
①碳棒上的红色物质是 ,无水硫酸铜的作用是 ;
②d中反应的离子方程式是 ;
③装置b中发生反应的化学方程式是 。
④电解CuCl2溶液时,阴极上产生白色物质的原因用电极反应式解释为 。
⑤阴极上产生白色物质的物质的量是 ;若装置b冷却时不继续通H2,则计算所得Cu+的产率会 (偏大、偏小、不变)。
查看答案和解析>>
科目:高中化学 来源:2013-2014学年北京市房山区高三一模理综化学试卷(解析版) 题型:选择题
下列离子方程式的书写与结论均合理的是
选项 | 离子方程式 | 结论 |
A | AgCl(s) + I-( aq) | 溶解度:AgI > AgCl |
B | Fe2++ H2O2 +2H+= Fe3++2H2O | 氧化性:H2O2 > Fe3+ |
C | CO32- + CO2 + H2O = 2HCO3- | 稳定性:HCO3- > CO32- |
D | NH3 + H3O+ = NH4+ + H2O | 得质子能力:NH3 > H2O |
查看答案和解析>>
科目:高中化学 来源:2013-2014学年上海市闵行区高三二模化学试卷(解析版) 题型:填空题
有机物A ( 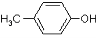 )是有机工业的重要原料,可用于合成多种有机物。
)是有机工业的重要原料,可用于合成多种有机物。
I.由A为原料,可以合成有机物D。根据如下流程回答:
已知:R-CN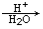 R-COOH。
R-COOH。
(1)A的名称为 ;
(2)D的结构简式为 。
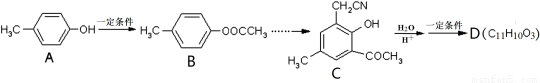
II.以A为主要原料合成有机物G: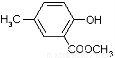 ,合成路线流程图为:
,合成路线流程图为:
(3)反应②的化学方程式 ;
(4)写出检验反应③的产物中残留有机反应物的试剂 ;
(5)写出符合下列条件的G的同分异构体的其中一种结构简式:①分子中含有苯环,且苯环上一氯代物只有一种;②能发生水解反应;③遇FeCl3溶液显紫色。 。
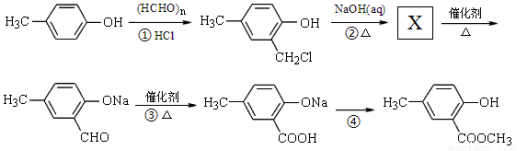
(6)根据已有知识并结合相关信息,写出以A的最简单同系物为原料制备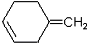 的合成路线流程图表示(有机物用结构简式,注明反应试剂和条件)
的合成路线流程图表示(有机物用结构简式,注明反应试剂和条件)
(合成路线常用的表示方式为:A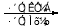 B……
B……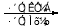 目标产物)
目标产物)
查看答案和解析>>
科目:高中化学 来源:2013-2014学年上海市徐汇、松江、金山三区高三二模化学试卷(解析版) 题型:选择题
1mol过氧化钠与2mol碳酸氢钠固体混合后,在密闭容器中加热充分反应,排出气体物质后冷却,残留的固体物质是
A.Na2CO3 B.Na2O2,Na2CO3
C.NaOH,Na2CO3 D.Na2O2,NaOH,Na2CO3
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com