
【题目】已知A是一种常见金属,F是一种红褐色沉淀。试根据图中转化关系,回答下列问题。

(1)写出A、C、F、G的化学式:A________;C________;F________;G________。
(2)保存C溶液时要加固体A的原因是______________________。
(3)写出下列转化的离子方程式。
①D→C:___________________________________________________;
②C→D:___________________________________________________;
③B→C+D__________________________________________________。
(4)写出E→F的化学方程式:__________________________________。
【答案】Fe FeCl2 Fe(OH)3 Fe2O3 防止Fe2+被O2氧化 2Fe3++Fe===3Fe2+ 2Fe2++Cl2===2Fe3++2Cl- Fe3O4+8H+===2Fe3++Fe2++4H2O 4Fe(OH)2+O2+2H2O===4Fe(OH)3
【解析】
A是一种常见金属,F是一种红褐色沉淀,由转化关系可知F为Fe(OH)3,A为Fe;Fe与氧气反应生成B为Fe3O4,四氧化三铁与盐酸反应得到氯化亚铁与氯化铁,故Fe与盐酸反应得到X为氢气、C为FeCl2,可推知E为Fe(OH)2、D为FeCl3,G为Fe2O3;C溶液为FeCl2溶液,亚铁离子易被氧化为铁离子,根据铁离子与铁单质反应生成亚铁离子分析解答。
A是一种常见金属,F是一种红褐色沉淀,由转化关系可知F为Fe(OH)3,A为Fe,Fe与氧气反应生成B为Fe3O4,四氧化三铁与盐酸反应得到氯化亚铁与氯化铁,故Fe与盐酸反应得到X为氢气、C为FeCl2,可推知E为Fe(OH)2、D为FeCl3,G为Fe2O3;
(1)由上述分析可知,A为Fe,C为FeCl2,F为Fe(OH)3,G为Fe2O3;综上所述,本题答案是:Fe,FeCl2,Fe(OH)3 ,Fe2O3。
(2)FeCl2易被空气中氧气氧化,保存FeCl2溶液时加固体Fe,防止Fe2+被氧气氧化;综上所述,本题答案是:防止Fe2+被O2氧化。
(3)①氯化铁与铁反应生成氯化亚铁,D→C的反应离子方程式为:2Fe3++Fe===3Fe2+;综上所述,本题答案是:2Fe3++Fe===3Fe2+。
②氯化亚铁与氯气反应生成氯化铁,C→D的反应离子方程式为:2Fe2++Cl2===2Fe3++2Cl- ;综上所述,本题答案是:2Fe2++Cl2===2Fe3++2Cl- 。
③四氧化三铁与盐酸反应生成氯化铁、氯化亚铁和水,B→C+D的反应离子方程式为:Fe3O4+8H+===2Fe3++Fe2++4H2O;综上所述,本题答案是:Fe3O4+8H+===2Fe3++Fe2++4H2O。
(4)氢氧化亚铁与氧气和水反应生成氢氧化铁,E→F的反应化学方程式为:4Fe(OH)2+O2+2H2O===4Fe(OH)3;综上所述,本题答案是:4Fe(OH)2+O2+2H2O===4Fe(OH)3。


科目:高中化学 来源: 题型:
【题目】将0.1mol的镁、铝混合物溶于100mL 2mol/LH2SO4溶液中,然后再滴加1mol/L NaOH溶液.若在滴加NaOH溶液的过程中,沉淀质量m随加入NaOH溶液的体积V变化如图所示.当V1=160mL时,则V2为

A.240mL B.300mL C.400mL D.440mL
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下面是某化学研究小组探究外界条件对化学反应速率和化学平衡影响的图像,其中图像和实验结论表达均正确的是( )


A. ①是其他条件一定时,反应速率随温度变化的图像,正反应ΔH<0
B. ②是在平衡体系的溶液中溶入少量KCl晶体后化学反应速率随时间变化的图像
C. ③是在有无催化剂存在下建立的平衡过程图像,a是使用催化剂时的曲线
D. ④是一定条件下,向含有一定量A的容器中逐渐加入B时的图像,压强p1>p2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有关下列四个常用电化学装置的叙述中,正确的是

A. 图Ⅰ所示电池中,MnO2是催化剂
B. 图Ⅱ所示电池放电过程中,硫酸浓度不断增大
C. 图Ⅲ所示装置工作过程中,电解质溶液中Cu2+浓度始终不变
D. 图Ⅳ所示电池工作过程中,电子由Zn极流向Ag2O极
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)研究氯气跟金属的反应时,选用金属铜进行实验。用坩埚钳夹住一束铜丝,灼热后立刻放入充满氯气的集气瓶里。铜丝燃烧后把少量水注入集气瓶里,用玻璃片盖住瓶口,振荡。
①根据哪些实验现象可判断铜丝燃烧后生成了+2价铜的化合物:_______________。
②反应的化学方程式为______________________________________________________。
(2)研究浓硫酸的强氧化性时,选用金属铜跟浓硫酸进行实验,实验装置如下图所示。
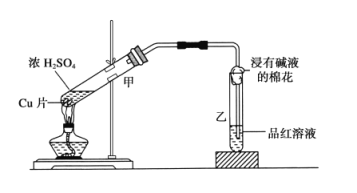
①乙中的现象_______,试管中的浸有碱液的棉花的作用是____________。
②甲中的反应方程式为_____________________________________。
(3)上述两个实验为什么都选金属铜作样本来进行实验________。
A.铜是一种不活泼金属
B.选用铜作实验可以推测更多金属跟氯气或浓硫酸反应的情况
C.铜是一种常见金属
D.铜跟氯气或浓硫酸反应可生成有色溶液,现象明显
查看答案和解析>>
科目:高中化学 来源: 题型:
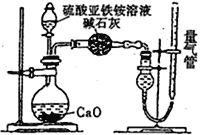
【题目】已知硫酸亚铁铵[(NH4)2SO4·FeSO4·6H2O]俗称莫尔盐,其摩尔质量为392 g/mol,可溶于水,在100℃~ 110 ℃时分解。为探究其化学组成,甲乙两同学设计了如下实验。
Ⅰ.探究莫尔盐晶体加热时的分解产物。
(1)甲同学设计如下图所示的装置进行实验,装置C中可观察到的现象是溶液变红,由此可知分解产物中有_____________。

(2)乙同学认为莫尔盐晶体分解的产物中还含有SO3(g)、SO2(g)及N2(g)。为验证产物的存在,用下列装置进行实验:

①乙组同学的实验中,装置依次连接的合理顺序为A→H→__________________________→G
②证明含有SO3的实验现象是_______________。
II.为测硫酸亚铁铵纯度,称取m g 莫尔盐样品,配成500 mL溶液。甲、乙两同学设计了如下两个实验方案。
甲方案:取25.00mL硫酸亚铁铵溶液用0.1000molL-1的酸性K2Cr2O7溶液分三次进行滴定。
乙方案:(通过NH4+测定)设计装置如下图所示。取25.00 mL样品溶液进行该实验。
(1)滴定过程中,酸性K2Cr2O7溶液应装在_____________滴定管中。甲方案中的离子方程式为_________________________________。
(2)乙方案中量气管中最佳试剂是______(填字母)。
a.水 b.饱和NaHCO3溶液 c.CC14
(3)乙方案中收集完气体并恢复至室温,读数前应进行的操作是______________________________。
(4)若测得NH3(已折算为标准状况下)为VL,则硫酸亚铁铵纯度为___________。(用含V、m的式子表示)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫酸亚铁是一种重要的化工原料,可以制备一系列物质(如下图所示)。下列说法错误的是( )

A. 碱式硫酸铁水解能产生Fe(OH)3胶体,可用作净水剂
B. 为防止NH4HCO3分解,生产FeCO3需在较低温度下进行
C. 可用KSCN溶液检验(NH4)2Fe(SO4)2是否被氧化
D. 常温下,(NH4)2Fe(SO4)2在水中的溶解度比FeSO4的大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硝酸是一种重要的化工原料,工业上采用氨的催化氧化法制备硝酸。
(1) 已知反应N2(g)+3H2(g) 2NH3(g)为放热反应,在恒容容器中能说明该反应达到平衡状态的是(_______)
A.容器内N2、H2、NH3的浓度之比为1:2:3
B. v正(N2)=v逆(H2)
C.容器内压强保持不变
D.混合气体的密度保持不变
(2)理论上,为了增大平衡时的转化率,可采取的措施是_____________(要求答出两点)
⑶合成氨技术的创立开辟了人工固氮的重要途径,合成氨反应的平衡常数K值和温度的关系如下表,则400℃时,测得某时刻氮气、氢气、氨气的物质的量浓度分别为1 mol·L-1、2 mol·L-1、3 mol·L-1时,此时刻该反应正反应速率_____ 逆反应速率(填“大于”、“小于”或“等于”)
温度/℃ | 200 | 300 | 400 |
K | 1.0 | 0.86 | 0.5 |
(4)消除硝酸工厂尾气的一种方法是用甲烷催化还原氮氧化物,已知:
① CH4 (g)+2O2(g)=CO2(g)+2H2O(g) △ H=-890.3 kJ·mol-1
② N2(g)+2O2(g)=2NO2(g) △ H=-67.0 kJ·mol-1
则CH4(g)将NO2(g)还原为N2(g)等的热化学方程式为___________________________________________
(5)在25 ℃下,向浓度均为0.1 mol·L-1的MgCl2和CuCl2混合溶液中逐滴加入氨水,先生成____沉淀(填化学式),当两种沉淀共存时,溶液中C(Mg2+)/C(Cu2+)=_________(已知25 ℃时Ksp[Mg(OH)2]=1.8×10-11,Ksp[Cu(OH)2]=2.2×10-20)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电子工业常用30%的FeCl3溶液腐蚀镀在绝缘板上的铜箔,制造印刷电路板。
(1)写出FeCl3溶液与金属铜发生反应的离子方程式:_________________________。
(2)某工程师为了从使用过的腐蚀废液中回收铜,并重新获得纯净的FeCl3溶液,准备用如图所示步骤:
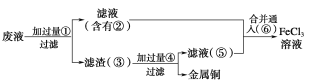
A.写出上述实验中加入或生成的有关物质的化学式:
①________;②________;③________;④________;⑤________;⑥________。
B.写出下列过程中的离子方程式:
①→②___________________________________;
⑤+⑥_______________________________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com